Хипермаркет знания >> Химия >> Химия >> Chemistry степен 10: Видове реактивните частици и механизмите на реакцията в органичната химия.
Най-характеристика на органични съединения ковалентна връзка е образувана от препокриването на атомна орбитала и образуване на електрони споделени двойки. Това води до общо две орбитален от атоми, която се споделя двойка електрони. На почивка връзка обща съдба на тези електрони може да бъде различна.
Exchange механизъм на образуване на ковалентна връзка. Homolytic разцепване връзка
Orbital с несдвоен електрон, принадлежащи към един атом може да се припокрива с орбитала на друг атом, който също е несдвоен електрон. В този случай, връзката се образува ковалентна на механизма обмен:
· + Н · Н -> N. Н или Н-Н
Размер на механизъм образуване на ковалентна връзка се осъществява, когато общата електронна двойка, образувана от несдвоени електрони, принадлежащи към различни атоми.
Метод образуване срещу ковалентна връзка на механизма обмен е пролука комуникация, при която всеки атом отклонява един електрон. В резултат на това двете незаредени частици образувани несдвоени електрони:
Такива частици, наречени свободни радикали.
Свободните радикали - атоми или групи от атоми, които имат несвоен електрони.
Механизъм разцепване ковалентна връзка, при което се образуват свободни радикали се нарича хемолитична или homolysis (хомо - .. Същото, т.е. тип резултати разцепване връзка в образуването на подобни частици).
Реакциите, които се извършват под влиянието и участието на свободните радикали, се наричат реакции на свободните радикали.
В хода на неорганична химия, които вече са се срещали с тези процеси. Тази реакция на водород с кислород, халогените, реакцията на горене. Моля, имайте предвид, че този тип реакция се характеризира с висока скорост, освобождаване на големи количества топлина. Причините за тези явления, както и самия механизъм реакции, специфични за органични съединения, ще разгледаме по-късно.
Донор-акцептор механизъм на образуване на ковалентна връзка. Хетеролитична връзка разцепване
Връзката на ковалентна може да бъде оформен и механизъм донор-акцептор план. Един от атомни орбитали (или анион), на която неразделен електронната двойка припокрива с друг празна орбитала на атома (или катион) като незаети орбитален, при което се образува ковалентна връзка, например:
Донор-акцептор механизъм образуване на ковалентна връзка се осъществява, когато общата електронна двойка, образувана от неразделен електронна двойка на един атом - донор. Вторият атом акцептор трябва да осигури незаети орбитален.
Метод разцепване ковалентна връзка, обратен неговото формиране на механизъм донор-акцептор - хетеролитична или п-teroliz, води до образуването на положително и отрицателно заредени частици, тъй като в този случай двете електрони от общата електронна двойка остават един от атомите в другата незапълнени орбити на атома се получават:
Вече е известно, че с нас от време на случай неорганична химия Heterolysis е електролитна дисоциация на киселини:
Това е лесно да се отгатне, че частица имаща свободна двойка електрони R: -. т. е. отрицателно зареден йон, ще бъдат привлечени от положително заредени атоми или атоми, в които има поне частичен положителен заряд или ефективно. Частици с самотен електронни двойки се наричат нуклеофилни средства (ядро - сърцевината на положително заредена част атом), т.е. "приятели" ядро положителен заряд ...
Нуклеофили (Nu) - аниони или молекули с nepode владение-електронна двойка, които взаимодействат с области на молекули, в които се концентрира ефективното положителен заряд.
Примери на нуклеофили: Cl - (хлорид анион) ОН - (хидроксид анион) SN3O - (метоксид анион), СН3СОО - (ацетат анион).
Частици, имащи незаети орбитали, от друга страна, ще са склонни да се запълни и, следователно, ще бъдат привлечени към частите на молекули, за които съществува повишен електронна плътност, отрицателно зареден, свободна електронна двойка. Те са електрофили, "приятели" електрони или отрицателни частици зареждане с повишена плътност електрон.
Електрофилите - катиони или молекули, имащи незапълнени електрон орбитали търсят електрони да се запълни, тъй като води до по-изгодно конфигурация Е-атом.
Не всяка частица с непопълнена орбитална е Електрофилът. Така, например, катиони на алкални метали са конфигурирани инертен газ и не са склонни да придобие електрони, тъй като те имат нисък афинитет електрон. От това можем да заключим, че, въпреки че имаше незапълнени орбитали, такива частици няма да елек.
Взаимното влияние на атомите в молекулите на органични съединения
Един от най-важните разпоредби на теорията на структурата на органични съединения, AM Butlerov е позицията, че свойствата на атома в молекулата се определят не само по своя характер, но и неговите непосредствена близост.
Преди да започнете да търсите в механизмите на реакциите на органични съединения, е необходимо да се разгледа същността на взаимното влияние на атоми и групи от атоми в органични съединения.
Индуктивен ефект. Разглеждане на разпределението на електронната плътност в молекула бромометан CH 3 Br. C-Br връзка в молекулата е полярен бромометан. Припомнете си, че полярността на свързване се определя чрез Електроотрицателност атоми на химични елементи, т. Е. Тяхната способност да привлича електрони в образуването на химична връзка.
Бром Електроотрицателност голяма от въглерод и получената бромен атом, се формира на частичен отрицателен заряд три-, и въглеродният атом, - частичен положителен заряд ™ +. електрон преместване по протежение на С-Br може да бъде показана по два начина - чрез определяне частично зареждане на атомите или стрелката по дължината на връзката.
СН ™ + -Вг три- СН3 -> Br
Преместването на електронна комуникация плътност срещащи се дължи на разлика в electronegativities атоми и групи от атоми засягане на наречен индуктивен ефект (I).
Ние се каже, че атом, с по-голям Електроотрицателност, привлича електрони, има отрицателно акцептор (да приеме - получат) ефект, който е означен -I.
Какво също може да доведе до I-ефект на бром?
Халогенният атом в молекула халоалкан (бром brommetane) лесно заменен с хидроксил анион под действието на воден алкален разтвор.
Хидроксилно анион се привлича към въглеродния атом (въглероден атом, атаки), която се фокусира частичен положителен заряд и замества бром, по-точно бромид анион.
молекула 1-хлоропропан електронна двойка на връзка С-С ^ е наклонено към хлорен атом поради своята голяма Електроотрицателност. В този случай въглеродният атом, за да се получи частично положителен заряд (§ +), издърпва електрони от свързан въглероден атом. че, от своя страна, за следното:
По този начин, индуктивен ефект се предава по веригата, но бързо избледнява: практически не се наблюдава в три арт-комуникация.
Да разгледаме различен реакция - присъединяване бромоводород да етен:
СН2 = СН2 + НВг -> СН3 SN2Vr
В началния етап на реакцията протича присъединяване водороден катион до молекула, съдържаща множествена връзка:
СН2 = СН2 + Н + -> СН2-СН3
Електрони л-изместен поради същия въглероден атом на съседните превърнати положителен заряд незапълнени орбитите.
Стабилност на тези частици се определя от това колко добре компенсира с положителния заряд на въглеродния атом. Тази компенсация възниква в резултат на изместване на електронната плътност и връзката към положително заредена въглеродния атом, т.е.. Е. Положителен индуктивен ефект (1).
Група атома, в този случай метилова група, който е изтеглен електронната плътност, донора има ефект, който е обозначен с 1.
Мезомерен ефект. Има и друг начин да повлияе някои от атомите или групите други - мезомерен ефект или ефект на свързване.
Разглеждане на молекула от 1,3-бутадиен:
Оказва се, че двойните връзки в молекулата - това не е само с две двойни връзки! Тъй като те са в непосредствена близост, припокриване възниква претенция -връзките включени в съседен двойно и се формира обща за всички четири въглеродни атома, п -electron облак. Системата (молекула) става по-стабилна. Това явление се нарича свързване (в този случай N - п -conjugate).
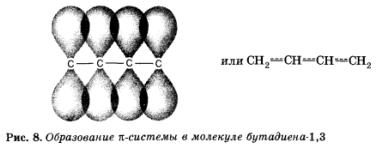
Допълнителна припокриване, L-двойка връзки, разделени от един О-връзка, води до тяхното "средно". Централна проста връзка придобива частичен "двоен" характер става по-силно и по-къси, а двойната - няколко отслаби и да удължат.
Друг пример е ефектът на конюгиране на двойната връзка от атом, имащ неразделен електронна двойка.
Например, когато киселина дисоциационна карбоксилна остава неразделен електронна двойка на кислороден атом:
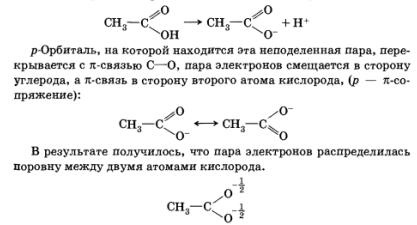
Това увеличава стабилността на аниона, образуван по време на дисоциация, увеличаване киселина сила.
Преместването на електронната плътност в спрегната система, включваща п-връзки или самотен двойки електрони наречен мезомерен ефект (М).
Основните механизми на реакции
Ние идентифицирахме три основни типа реактивни частици - свободни радикали, електрофили, нуклеофили и три съответния вид механизми реакционни:
• свободните радикали;
• електрофилно;
• нуклеофилно.
Освен това реакцията на маркиране в зависимост от вида на реагиращите видове в органичната химия разграничат четири типа реакции на принципа на промяна на състава на молекули: (. От английски за елиминиране - изтриване, разцепва) добавяне, заместване, премахване, или елиминиране и прегрупиране. Тъй като добавянето и заместване може да се осъществи под влиянието на трите вида, които са в състояние reaktsionnospo частици, има няколко основни реакции протичат механизми.
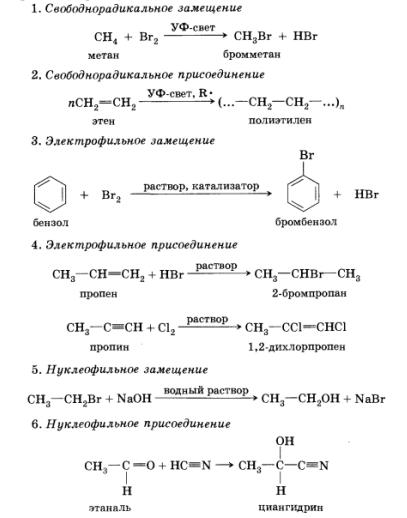
В допълнение, ние ще разгледаме по разцепване, или премахване, които са под влиянието на -нуклеофилни видове - причини.
Ние можем да предположим, че в тази реакция, бромоводород се отцепва от молекула на 2-бромоетан молекула. В присъствието на алкално и натриев бромид образува вода.
1. Каква е homolytic и хетеролитично паузи ковалентна връзка? Кои механизми на образуване на ковалентна връзка, те са характерни?
2. Какво се нарича елек и нуклеофили? Дайте им примери.
3. Каква е разликата между индуктивни и мезомерни ефекти? Тъй като тези явления илюстрират позицията на теорията на структурата на органични съединения, AM Butlerov взаимното влияние на атомите в молекулите на органични вещества?
4. В светлината на индуктивен и мезомерен ефект разглежда взаимното влияние на атомите в молекули:
Потвърждаване на техните констатации примери за уравнения на химични реакции.
Ако имате корекции или предложения на този урок, моля свържете се с нас.
Ако искате да видите и другите корекции и предложения за уроци, погледнете тук - Образователен форум.
