урок на тема - "Съставът на атомните ядра на изотопи.". Повтаряме какъв елементарен модел на атома, неговата структура е подобна на нашата слънчева система. Ние разберете какво година физици са се научили от опита на Ръдърфорд, от който всъщност се състои от ядро, нейната плътност, как да се получи нов елемент, като добавите към него протона.
Относно: Периодичен закон и периодичната таблица на елементите Г. I.Mendeleeva
1. Структура на Atom
Елементен атом всъщност се оказа комплекс на частиците, който се състои от ядро и обвивка електрон. Според неговата структура е подобна на слънчевата система. В нашата слънчева система се намира в центъра на масата на Слънцето, и в атома - ядрото. Тя се върти около планетата слънце, в атом - електрони. Този модел на атома създадена през 1910 г. от Ernest Rutherford. Едва през 1932 г., физиците открили, че ядрото на атома се състои от елементарни частици: протони - положително заредени и без такса - неутрони.
Atom като отгатнеш Ръдърфорд почти празно пространство с ядрото в средата. Ядро - много гъста образование, състоящ се от протони и неутрони. атомно ядро плътност възлиза на 100 000 тона / mm3. Добавянето на протон в ядрото на атома, всеки път се получава нов елемент. Ако ядрото на един протон Н е водород, ако 2 - не е хелий, ако този 3- литиев Ли. И така нататък.
Твърди се, че протоните дават атом индивидуалност. Но неутрони не са повлияли на отделните атоми, но се записват само на теглото на елемента.
2. нуклиди
Нуклиди - е частица, които имат специфичен масово число и време на живот, достатъчна за тяхното изследване. Нуклиди са разделени в
- стабилна. Стабилен изотоп не претърпяват спонтанно радиоактивно разпадане.
- радиоактивни или радионуклиди. Радиоактивните частици може спонтанно да се разпадат, за да се образува останали нуклиди.
Радиоактивните частици са разпределени в
Дългоживеещите радионуклиди са възникнали със Земята. Техният полуживот е 5 ∙ 108let.
Най-голямо количество радионуклид 34 има платина Pt и осмиев Os. Някои статии имат само един стабилен изотоп. Например, злато Au и кобалт Co. Максималният брой на стабилен изотоп 10 има калай Sn. Много елементи на всички радионуклиди - радиоактивни. Това са всички елементи, които имат атомно число по-голямо от това на олово Pb, и технеций Tc и прометий рМ. Общият брой на всички нуклиди всички елементи надхвърля 3100.
3. Концепцията за изотопи
броя на неутроните в ядрото на един атом се нарича изотопен брой и е означен с Н.
Ако атом съдържа същия брой протони. т. е. има същата такса, но различен брой неутрони. тя ще има различен маса. Тези атоми са наречени изотопи.
N - брой на изотопен
A - масово число
Z - брой такса
Когато се отнася до броя на изотопи на химичен елемент със символ в горния ляв ъгъл на масовото число, е написано, и в ляво в дъното на - такса номер. 612с. Понякога можете да намерите следната позиция: въглерод -12.
Някои изотопи имат свое собствено име. Това е характеристика на водородни изотопи и радонова. водородни изотопи 1Н - протий, 2Н - деутерий, 3H - тритий.
Възможно е също така да отговаря на кислородни изотопи 16O, 17O, 18О, които се срещат в природата.
Относителната атомна маса елемент

Фиг. 1. хлорни изотопи
Атомът е много малък и теглото му трябва да бъде незначително. През 1961 г. в Международния конгрес по теоретична и приложна химия, физика и химици реши, че масата на атома ще се измерва не в килограми или грамове, и в единици, известен като атомна маса единица (а. EM). Приема се, че изотоп на въглерода е -12, като най-стабилните в природата ще има тегло от 12. EM атомна маса единица е равна по размер:
1 мол от всяко вещество съдържа частици равен брой Авогадро.
4. хлорни изотопи
Относителна атомна маса елемент, който се съдържа в периодичната система - е средната стойност на масови числа на естествени изотопи на базата на техния дял в природата.
Например, всички атоми, представени в природата изотопи на хлор 35С (75%) и 37 Cl (25%). Фиг.1.
Относителната атомното тегло на хлор се изчислява по формулата = 35.5.
5. водород Изотопи
Водороден атом, имащ протон в ядрото и с неутрони наречен протий. "Протасов," - първична. Така нареченият първи изотоп на водорода.
Фиг. 2. водородни изотопи деутерий
Ако водороден атом от допълнение протон също включва един неутрони. тя ще се нарече деутерий.
Деутерий газ водород, двуатомен молекула D2.
Този газ в атмосферата е много малък, само 0012 от общото тегло на водород газ. Деутерий и е част от тежка вода. Неговата формула е D2O. Неговите физични свойства са различни от физичните свойства на обикновената вода. Tab.1.
Сравнението на физичните свойства на тежка вода от обикновена.
6. Войната за тежка вода

Фиг. 3. Завод за производство на тежка вода в Норвегия
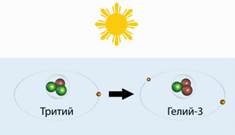
Съставът включва 2 тритий неутрони и протон 1. Обозначени с буквата Т .. Тритий - краткотраен изотоп на водорода. Той е роден в горните слоеве на атмосферата, причинени от космически лъчи.
Родена да умре там, а след това - да се превърне в хелий-3.
само 6 грама му в цяла нашата атмосфера. 1 тритий атом представлява 10 cm3 на въздух.
7. Когато се използва тритий?
природни резервати тритий са незначителни. Затова всички тритий, който се използва в промишлеността, приготвен по изкуствен начин. Чрез бомбардиране с неутроните литиеви атоми. Тритий се използва за създаване на светлочувствителни багрила, които се прилагат към различни устройства. Например, може да се види по време на фосфор, при която светлинните стрелките в тъмното. Акциите на тритий при хора е пренебрежимо малка. И все пак, ние се тритий в организма от въздуха и храната.
Тритий газ е 500 пъти по-малко токсичен от тритий, част от изключително тежка вода за човешкото тяло. Това е така, защото газообразен тритий отделят в рамките на три минути, и тритий, част от изключително тежка вода, след 10 дни. По този начин, хората, които консумират понякога допълнително тежка вода, увеличаване на нивата на радиация на организма. Трябва да се отбележи, че ако човек носи часовник, ръцете са покрити с фосфор, използвайки тритий, 5 пъти по-податливи на радиация, отколкото един обикновен човек.
Фактът, че има три водород изотопи, не го разпределя между химичните елементи. Водородни изотопи са различни един от друг и от физичните и химични свойства. Това не е типично за други атоми. Водородни изотопи са различни един от друг и от физичните и химични свойства, тъй като те имат много различна маса. Проучване на изотопи на водород, учените заключават, че химичните свойства на елемента удобно проучени от примера на техните изотопи.
Така се ражда нова област на химията - химията на изотопи.
8. ядро атом
Ядрата със същия брой неутрони но различен брой протони се наричат изотонични. Изотонични. Името "IZOTON" е измислена въз основа на думата "изотоп". Чрез заместване на "п" (протон) в "N" (неутрони). Примери isotones изотопи и могат да бъдат използвани. Лесно е да се изчисли, че в тези IZOTON 7 неутрони.
Изотопи с една и съща маса номера се наричат isobars. isobars; др-grech.ἴσος (ISOs) - «същите» + βάρος (Baros) - «w»). Например :. Броят и протоните и неутроните в isobars различни.
Атомното ядро се състои от протони, положително заредени и неутрони нямат никаква такса. Всяка от тези частици е 1 и теглото. EM Броят на протоните и неутроните в ядрото определя масовото число на атома. Ако броят на протоните в ядрото е постоянна и различен брой неутрони, такива атоми са наречени изотопи.
Обобщавайки резултатите от урока.
В урока повтаряте колко елементарен модел на атома, неговата структура е подобна на нашата слънчева система. Ние разберете какво година физици са се научили от опита на Ръдърфорд, от който всъщност се състои от ядро, нейната плътност, как да се получи нов елемент, като добавите към него протона.
Списъкът на препоръчителна четене
Препоръчителни връзки към онлайн ресурси
Препоръчителна домашна работа
2. Какви са изотопи и isobars IZOTON?
3. Списък на водородни изотопи, техните имена и състав.
Зарежда.
Вие трябва да изтеглите учебните планове по темата "Съставът на атомните ядра. Изотопи (Chemical степен 9). Hold връзка
Зарежда.
Известни произведения
- Пейзажи в текста на S.Pushkina
- Анализ Blok стихотворение "В областта Kulikovom"
- Баща и син в историята Г. Олдридж "The Last Inch"
- Живота и творчеството на Гьоте VI
- Решенията на арбитражния съд. задачи
- Проектиране кетъринг дизайн закусвалня. част 2
- А. и S. S.Pushkin A.Esenin на руски характер
-
Статистика проекта
