Серен е широко разпространен в природата. Това е 0.05% от теглото на земната кора. В свободно състояние (сяра) открити в големи количества в Италия (Сицилия) и Съединените щати. Депозити на родния сяра са в региона Kuibyshev (Поволжието), в държавите от Централна Азия, в Крим и други региони.
Сярата е често се срещат под формата на съединения с други елементи. Най-важните природни съединения са сулфидите на металите: FeS2 - желязо пирит, или пирит; HGS - алено и т.н., и соли на сярна киселина (кристален хидрат) :. CaSO4 ּ 2 H2O - гипс, Na2SO4 ּ 10 H2O - глауберова сол, MgSO 4 ּ 7 H2O - английска сол и др.
Физични свойства на сяра
Природен сяра се състои от смес от четири стабилни изотопи:
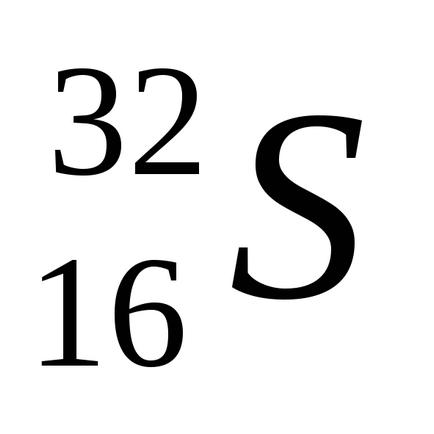

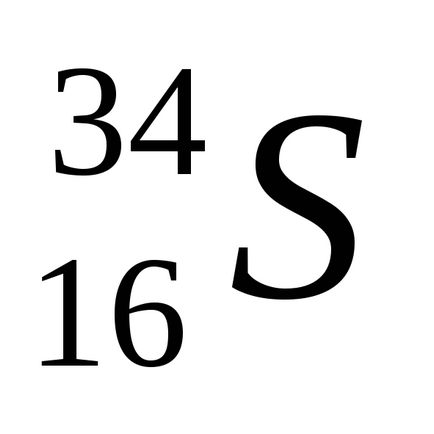
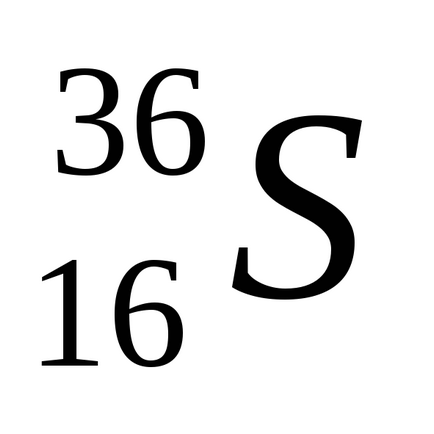
Серни форми няколко алотропна модификации. Стабилен при стайна температура ромбично сяра е жълт прах, слабо разтворим във вода, но разтворими във въглероден дисулфид, анилин и други разтворители. Лошо провеждане на топлинна и електрическа енергия. Кристализация от hloroformaCHCl3 serouglerodaCS2 или тя стои по прозрачен осмостенно кристална форма. Ромбично сяра се състои от цикличен molekulS8. оформена корона. В 113 0 Cona топи, се превръща в жълт тънък течност. При допълнително отопление на стопилката се сгъсти, тъй като тя формира дълги полимерни вериги. Ако сяра загрява до 444,6 0 ° С, се свежда. Изливане на кипене сяра тънка струя в студена вода може poluchitplasticheskuyu сяра - гумено-модифицирани, състояща се от полимерни вериги. На бавно охлаждане на стопилката образуват тъмни жълти игли kristallymonoklinnoy сяра. (Точка на топене = 119 0 ° С). Както ромбично сяра, тази модификация се състои от molekulS8. При стайна температура, пластмаса и моноклинна сяра нестабилна и спонтанно се превръща в орторомбична сяра на прах.
Химичните свойства на сяра и неговите съединения
Свойствата на прост вещество.
Серен атом, като незавършен външната енергийно ниво, два електрона могат да се прикрепят и да окисление -2. Тази степен на окисление на сярата експонати в съединения с метали и водород (например, Na2S iH2S). По време на възстановяване, или издърпване на електрон на атом повече електроотрицателна елемент степен на окисление на сярата може да бъде 2, 4 и 6.
Сярата лесно образува съединения с много елементи. На горене на въздух или кислород е оформен серен оксид (IV) SO2 и частично серен оксид (VI) SO3:
2S + 3o2 = 2so3
Това е най-важните серни оксиди.
Чрез нагряване директно сярата комбинира с водород, халоген (различни от йод), фосфор, въглерод, а също и с всички метали с изключение на злато, платина и иридий. Например:
3S + = 2p p2s3
2S + с = CS2
Както следва от примерите, в реакции с метали и някои неметали е серен окислител, в реакциите с повече активни неметали, като кислород, хлор, - с редуциращ агент.
Серен диоксид SO2 - безцветен газ с задушава остра миризма. Когато разтваря във вода (при 0 0 ° С 1 обем вода разтваря повече obemovSO2 70), оформен серниста kislotaH2SO3. който е известен само в разтвор.
При лабораторни условия за получаване на SO2 работят на твърд натриев сулфит, концентрирана сярна киселина:
В промишлени SO2 се получават чрез пържене на сулфидни руди, като пирит:
Свързани статии
