Едно от уникалните свойства на живите организми е тяхната забележителна способност да поддържа баланса в катаболните (biodegra-дателен) и анаболни (биосинтез) процеси. В клетките едновременно възникне процеси на синтез, разлагане и Взаимното превръщане на стотици или хиляди различни вещества. което от своя страна се уреждат от различни механизми, които да гарантират, постоянството на вътрешната среда на организма. Някои от тези регулаторни механизми, сред които важна роля играе механизмите за регулиране на синтез и каталитичната активност на ензими. Те ще бъдат обсъдени по-късно.
Влиянието на маса закона за действие. Обратимото ензим-катализирани химична реакция. например A + B <=> C + D, концентрацията на компонентите на реакцията и по този начин посоката на реакцията ще се ръководи от влиянието на маса закона за действие. Това е по-специално може да бъде показано на обратима реакция на трансаминиране. катализира от ензима аминотрансфераза аланин:
аланин + # 945; кетоглутарат <=> Пируват + глутамат.
Този тип регулиране играе очевидно само ограничена роля, тъй като при реални условия на реакцията обикновено протича в една посока, като получените продукти могат да бъдат субстрати за действието на други ензими и изхода от реакционната зона. В тези случаи, тя определя по-скоро стабилна (стационарен) състояние, отколкото истинския баланс.
Промяната на количеството ензим. На бактерии е добре проучен феномен индуцирана (индуциране) синтезиране ензим когато се отглежда в среда, където единствен въглероден и енергиен източник е един или друг въглехидратен. например глюкоза. Замяна на глюкозата в средата на лактоза (индуктор) води до индуцирана или адаптивна (след леко период на забавяне фаза) синтез ензим галактозидаза (програмирана лактоза ген. Виж гл. 13), която разцепва лактоза в глюкоза и галактоза.
В клетките на прокариоти и еукариоти са ензими. концентрация, която не изисква добавяне на индуктор; така наречените конститутивни ензими. Количеството ензим в клетката зависи от наличието на реакционния продукт. катализирана от този ензим. при което реакционният продукт причинява инхибиране на синтезата на ензима в резултат на изтласкването (вж. и т.н.).
В животински тъкани бърз синтез на ензими е по-рядко. Неговият механизъм (индуциране на синтеза) проучен само за малък брой ензими. tirozintransaminazy, серин и треонин, и т.н. triptofanpirrolazu -. в отговор на приемане на въвеждането на хормони или протеин. Въпреки това, когато тялото на някои отрови, канцерогенни вещества. алкалоиди. инсектициди в няколко дни, рязко увеличение на активността (или количеството) хидроксилаза ензими (монооксигенази) ендоплазмения ретикулум на чернодробните клетки. окисляващ чужди вещества в нетоксични продукти за тялото. Това е приемливо да се предположи, че в такива случаи се извършва чрез индуциране на синтеза на ензими (т.е., де ново). Има случаи, когато действието хидроксилази тези чужди вещества се превръщат в тялото в по-токсично съединение. Това явление, противоположна детоксикация, е наречен летална синтез.
Проензими. Протеолитични ензими на храносмилателния тракт и панкреаса се синтезират в неактивна форма - като проензими (зимогени). Регламент в тези случаи се свежда до трансформиране зимогени в активни ензими от влиянието на специфични средства или други ензими - протеази. Така трипсин се синтезира в панкреаса под формата на неактивен трипсиноген. Въвеждане в червата се превръща в активен трипсин в резултат автокатализ или под влиянието на други протеази (активиран механизъм се обсъжда по-подробно в глава 12). Превръщането Пепси nogena неактивни в активен пепсин настъпва autocatalytically от специфично ограничена протеолиза в присъствието на солна киселина и се свързва с разцепването на проензим специфичен инхибитор пептид. Конвертирането на зимогени на активни ензими, свързани с конформационни промени в ензимни молекули и образуването на активния център или разкриване (оголване). Синтез на протеази в неактивна форма и редица други неактивни прекурсори протеини е очевидно определен биологичен смисъл, предотвратяване на разрушаването на клетъчните тела, в които се образуват проензими. Примери за такива активиране е активиране на определени протеини, хормони (проинсулин -> инсулин), протеин на съединителната тъкан (разтворим проколаген превръща в неразтворим колаген), протеини на системата на кръвосъсирването.
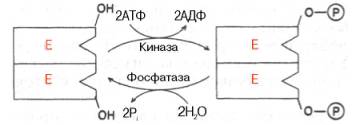
Фиг. 4.23. Ковалентна модификация чрез фосфорилиране ензим дефосфо rilirovaniya серинови остатъци.
Фиг. 4.24. Не-ковалентна модификация на ензима по аденилация deadeni-регламента.
Химична модификация на ензим. Няколко протеини в образуването на третична структура postsynthetic подложени на химическа модификация (виж гл. 1). Установено е, че активността на няколко ключови ензими на въглехидратния метаболизъм. . По-специално фосфорилаза, гликоген и т.н. също се контролира от фосфорилирането и defosforili-нето, изпълняван от специфични ензими - протеин киназа и протеин фосфатази, които от своя страна активност се регулира от хормони (виж Глава 10). Нивото на активност на ключови ензими на въглехидратния метаболизъм и по този начин интензивността и посоката на обмен процеси се се определя от съотношението на фосфорилирани и де-фосфорилирани форми на тези ензими.
Обикновено се разграничат обратими ковалентни и нековалентни химични модификации ензими. осъществява чрез ОН-група на серин. най-малко - тирозин, или чрез нековалентни взаимодействия с молекула ензим. В първия случай, че ензимът е активен или фосфо-rilirovannaya или дефосфорилиран форма, както е в случая с молекулите на фосфорилаза мускулна гликоген и съответно (виж гл. 10). Примери, които могат да бъдат под формата на две вериги настоящото тип модификация, в която символът R означава фосфатен остатък. Pi - неорганичен фосфат (Н 3РО 4) PPI - неорганичен пирофосфат (H4 Р2 О7), AMP - (. Фигура 4.23, 4.24) adenylic киселинен остатък.
Химически postsynthetic модификация ензими включват, в допълнение, ограничени процеси протеолиза (вж. По-горе), метилиране (виж гл. 13), гликозилиране uridilirovaniya, аденилация, ADP-рибозилиране, и други. По този начин се осигурява микроскопични
Алостерична регулиране. В много биосинтетични реакции силно основен регулиране тип многостепенен скорост на ензимен процес е инхибирането на обратна връзка. Това означава, че крайният продукт биосинтетичен верига инхибира ензимната активност. катализира първия етап на синтеза, което е ключът към тази верижна реакция. Тъй като крайният продукт е структурно различен от субстрата. се свързва с allostery кал (некаталитична) център на молекулата на ензим. причинявайки ingibi-ЛИЗАЦИЯ цялата синтетична реакция верига.
Да приемем, че клетките проведени биосинтетичен многоетапен процес, всяка стъпка, която се катализира от ензима собствена:
Размерът на тази общата реакционна последователност голяма степен се определя от концентрацията на крайния продукт Р, които се натрупват над допустимото ниво проявява силен ефект Ingi-biruyuschee първия етап на процеса и следователно ензима Е1.
Наличието на такъв механизъм за контрол на ензимни метаболити дейност бяха намерени в E.coli при синтеза проучване изолевцин и CTP а. Установено е, че изолевцин. което е краен продукт на синтеза, селективно инхибира активността на треонин дехидратаза, който катализира първия етап на процеса на сериен превръщане на треонин с изолевцин. Има пет ензимни реакции:
Подобно CTP като краен продукт на биосинтетичния път има инхибиторен ефект върху първия ензим (aspartatkarbamoiltran-sferazu), като по този начин регулиране на тяхната собствена синтез (виж гл. 13). Този тип на инхибиране се нарича инхибиране на обратна връзка или инхибиране обратна връзка. Неговото съществуване е доказано във всички живи организми. В момента той е считан за един от водещите видове регулиране на ензимната активност и метаболизма на клетките като цяло.
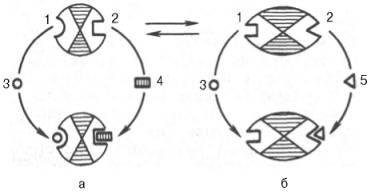
Фиг. 4.25. Allo пространствено взаимодействие на ензима със субстрат и ефектори (схема).
и - активен комплект; б - неактивен комплекс; 1 - активното място; 2 - алостеричен център; 3 - субстрат; 4 - положителен ефектор; 5 - отрицателен ефектор.
От друга страна, в amfibolicheskih процеси изпълнява едновременно и biodegradativnye биосинтетичен функция. доказано съществуването на регулиране като вид на инхибиране обратна връзка и macroergs кал връзки - показатели енергийно състояние на клетката. За amfibolicheskih обработва уникален вид на регулиране, особен само до тях, също така е активиране прекурсор. когато първият метаболит в мулти-начин активира ензима. катализира последната стъпка. По този начин, е доказано активиращ ефект на глюкоза-6-фосфат, прекурсор на гликоген. на синтаза на ензима гликоген.
Подобни видове инхибиране на крайния продукт и активиране на първия характеризиращ продукт алостерични (регулаторни) ензими. Когато ефекторна, модулатор, структурно различни от субстрата. свързан в частност (алостеричен) център на молекулата на ензим. пространствено отдалечени от активното място. Все пак трябва да се има предвид, че модулатори на ензима може да бъде като активатори. и инхибитори. Това често се случва, че самата субстрата има активиращ ефект. Ензими. и за които субстрата. и модулатор представен с идентични структури се наричат gomotropnyh разлика хетеротрофична ензим. който модулатор има отлична от структурата на субстрата. Взаимното превръщане на активна и неактивна алостеричен ензим в опростена форма, както и промени конформацията-мация наблюдавани при присъединяването на субстрата и на ефектори са показани на Фиг. 4.25. Присъединяване отрицателен алостеричен ефектор към център причинява значителни промени в конфигурацията на активния център на молекулата на ензим. при което ензимът губи неговия афинитет за нейния субстрат (образуването на неактивни комплекс).
Алостеричните взаимодействия се проявяват в криви характер началната скорост на реакция на концентрация на субстрата или ефекторна, особено в S-кривите на изображения (отклонение от хиперболична крива на Michaelis-Menten). S-образна зависимост от V [S] в присъствието на модулатора дължи на ефекта на кооперативност. Това означава, че свързването на молекула субстрат улеснява свързването на втората молекула в активното място. като по този начин допринася за увеличаване на скоростта на реакцията. Освен това, алостерична регулаторни ензими за нелинейна характеристика на зависимостта на скоростта на реакцията на концентрацията на субстрата.
Други видове регулиране на ензимната активност. Абсолютната количеството ензим, наличен в клетката, регулирано от времето на неговия синтез и разпад. За регулаторни механизми могат да бъдат класифицирани като конкуренцията за цялостното ензимен субстрат. един от активност на изоензими (от множество форми на ензими), концентрация въздействие
ционните кофактори и феномена на раздробяване. Механизъм БКП-mentalisation метаболитни процеси е очевидно важна биологична роля пространствено отрязване чрез биомембрани ензими с техните субстрати (например лизозомна ензими протеиназа, фосфатаза, РНКаза и други хидролитични ензими -... цитоплазмен вещества, които действат) , В допълнение, за улесняване независимо регулиране, този механизъм позволява да се раздели несъвместими в едно и също място (а вероятно и в същото време) метаболитни процеси. Пример на последната може да бъде начин за синтез на висши мастни киселини. срещащи се главно в разтворим цитоплазмен фракция. и път гниене (окисляване) на мастни киселини. се концентрира в митохондриите. Трябва да укажете, обаче, че ако някой partmentalizatsii проблем на транспорта като метаболити. и намаляване еквивалента чрез биомембрани субклетъчна оп-ganell. Този проблем е решен чрез т.нар трансфер механизъм, който позволява предаване на метаболити във формите, които могат да преминат през мембраната. и осигуряване на вътреклетъчния хомеостаза (виж гл. 13).

