Първичната структура на протеини е линейна полипептидна верига от аминокиселини, свързани заедно чрез пептидни връзки. Първичната структура - простият нивото на структурна организация на протеиновата молекула. Тя дава висока стабилност ковалентна пептидни връзки между # 945-амино група на една амино киселина и # 945; карбоксилна група на друга аминокиселина
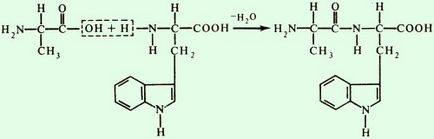
Ако образуването на пептидни връзки, участващи имино пролин или хидроксипролин, тя има различен поглед
При образуването на пептидни връзки в клетките първоначално активирана карбоксилна група на една амино киселина, и след това се свързва с амино група на друг. За да извършват лабораторни синтез на полипептиди.
връзката пептидът е повтаряща се единица на полипептидната верига. Тя има редица функции, които засягат не само формата на първичната структура, но и на по-високи нива на организация на полипептидната верига:
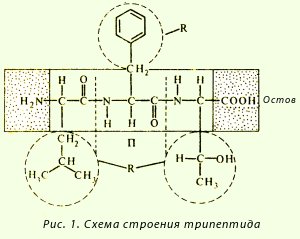
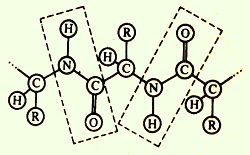
· Успоредностмежду - всички атоми, включени в пептидната група са в една и съща равнина;
· Възможност да съществува в две резонансни форми (кето или енолна форма);
· Транс-позиция по отношение на заместители, C-N-връзка;
· Способността да образуват водородни връзки с всеки от пептидните групи могат да образуват две водородни връзки с други групи, включително пептида.
Изключение е пептид с амино групата на пролин или хидроксипролин. Те са способни да образуват само една водородна връзка (вж. По-горе). Тя засяга образуването на протеин вторична структура. полипептидната верига на място, където има пролин или хидроксипролин, огъва лесно, тъй като не задържа както обикновено, втора водородна връзка.
образуване схема трипептид:
Нивата на пространствена организация на протеини: вторична структура на протеини: понятието # 945; спирала и # 946; -skladchatom слой. Третичната структура на протеини: концепцията на нативния протеин и протеин денатуриране. На четвъртичната структура на протеините на пример на структурата на хемоглобина.
Вторичната структура на протеина. Съгласно вторичната структура на протеин полипептидната верига да се разбере метода на подреждане подредена структура. Според конфигурацията са следните елементи на вторична структура: # 945; спирала и # 946; -skladchaty слой.
модел на структура # 945; спирала, която взема предвид всички свойства на пептидната връзка, е разработен от L. Полинг и Robert Corey (1949-1951 GG.).
На фигура 3 схематично # 945; спирала, която дава представа за неговите основни параметри. Полипептидна верига гънки в # 945; спирала, така че намотките на спирала са редовни, следователно, има спирална спирална конфигурация симетрия (фиг. 3b). На всеки ход # 945; за 3.6 спирала аминокиселинни остатъци. Разстоянието между навивките или стъпката на спиралата е 0.54 пМ, ъгъл на повдигане намотка е 26 °. Изграждане и поддържане на # 945; Той се среща спирална конфигурация от водородни връзки, образувани между пептидни групи на всеки N-ти и (п + 3) та аминокиселинни остатъци. Въпреки че енергията на водородни връзки е малък, голяма част от тях води до значително енергия ефект, при което # 945; спирална конфигурация е доста стабилен. Странични групи на аминокиселинни остатъци, които не участват в поддържането на # 945; спирална конфигурация, така че всички аминокиселинни остатъци # 945; спирала еквивалент.
Естествените протеини съществуват само pravozakruchennye # 945; спирала.
# 946; -Skladchaty слой - на втория елемент на вторичната структура. за разлика от # 945; спирала # 946; -skladchaty слой има линейна и не форма на прът (фиг. 4). Линейната структура се поддържа от производството на водородни връзки между пептидни групи, намиращи се върху различни части на полипептидната верига. Тези области са близко разположени на разстояние на водородна връзка между - С = О и HN - групи (0.272 пМ).
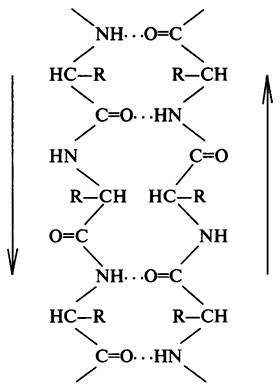
Фиг. 4. Схематично представяне на # 946; -skladchatogo слой (показано със стрелките
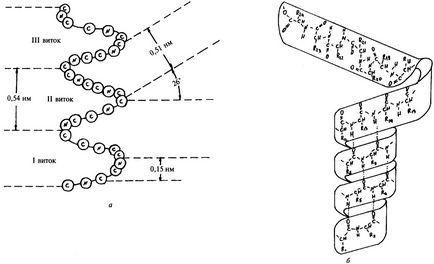
Фиг. Схема 3. (а) и модела (б) # 945; спирала
Вторична структура, определена от първичен протеин. Аминокиселинните остатъци в различна степен, способни да образуват водородни връзки, и това се отразява на образуването на # 945; спирала или # 946; тип слой. Чрез spiraleobrazuyuschim аминокиселини включват аланин, глутаминова киселина, глутамин, левцин, лизин, метионин и хистидин. Ако фрагмент протеин се състои предимно от аминокиселинни остатъци, посочени по-горе, се образува на мястото # 945; спирала. Валин, изолевцин, треонин, фенилаланин, тирозин, и насърчаване на образуването на # 946; -layers полипептидна верига. Неподредени структури възникват в сайтове на полипептидната верига, където остатъци като аминокиселинни се концентрира като глицин, серин, аспарагинова киселина, аспарагин, пролин.
В много протеини в същото време има # 945; спирала, и # 946; -fibers. Съотношение спирална конфигурация в различни протеини се различават. По този начин, мускулния протеин paramyosin на почти 100% spiralized; голяма част от спирална конфигурация в миоглобин и хемоглобин (75%). В контраст, трипсин, и рибонуклеаза значителна част от полипептидната верига се вписва в слоести # 946; -структура. Протеини поддържащи тъкани - кератин (коса протеин), колаген (кожата протеин и сухожилия) - са # 946; конфигурация, полипептидни вериги.
Третичната структура на протеина. Третичната структура на протеина - това е метод за полагане на полипептидна верига в пространството. За придобита протеинови присъщите функционални свойства, полипептидната верига трябва да кратно по определен начин в пространството, образувайки функционално активен структура. Такава структура се нарича роден. Въпреки големия брой теоретично възможно единична полипептидна верига на пространствени модели на протеин сгъване води до образуването само на нативния конфигурация.
Стабилизиране протеинови взаимодействия третична структура, настъпващи между страничните радикали на амино киселинни остатъци на различни части на полипептидната верига. Тези взаимодействия могат да бъдат разделени на силните и слабите страни.
За силни взаимодействия включват ковалентни връзки между серните атоми на цистеинови остатъци, изправени в различни части на полипептидната верига. В противен случай тези връзки се наричат дисулфидни мостове; образуване на дисулфиден мост може да бъде представена както следва:
Освен ковалентни връзки третична структура на молекулата на протеин се поддържа от слабите взаимодействия, които от своя страна са разделени в полярен и неполярен.
За полярни взаимодействия включват нейонни и водородни връзки. Йонни взаимодействия се образуват по време на контакт на положително заредени групи на страничните вериги на лизин, аргинин, хистидин и отрицателно заредени СООН групи от аспарагинова и глутаминова киселина. Водородни връзки се появяват между функционалните странични групи на аминокиселинни остатъци групи.
Или неполярен ван дер Ваалс взаимодействия между аминокиселинни остатъци въглеводородни радикали, допринасят за образуването на хидрофобна сърцевина (мастни капчици) в протеин глобули, както въглеводородни радикали са склонни да се избегне контакт с вода. повече неполярен Аминокиселинният състав на протеини, основна роля при формирането му третична структура играе ван дер Ваалс връзки.
Множество връзки между страничните вериги на амино киселинни остатъци на протеина определят пространствената конфигурация на молекулата (Фиг. 5).
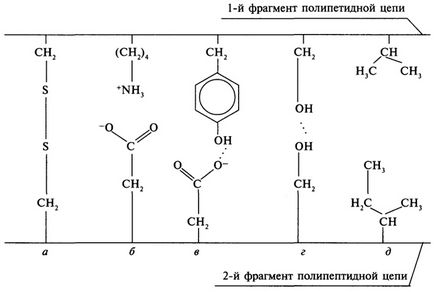
Фиг. 5. видове връзки, които поддържат третичната структура на протеин:
и - дисулфиден мост; б - йонна връзка; С, D - водородни връзки;
г - ван дер Ваалс връзка
Третичната структура на протеина е уникален индивид като уникален и неговата първична структура. Само правилното устройство на опаковката на протеина го прави активен. Различни нарушения на третичната структура на резултата от протеин в промяна на свойствата и загуба на биологична активност.
Кватернера протеин sturkture. Протеини с молекулна маса по-голяма от 100 Ша 1 обикновено се състоят от няколко полипептидни вериги с относително ниско молекулно тегло. Структура, състояща се от няколко полипептидни вериги, заемащи строго фиксирано положение един спрямо друг, при което протеинът има особена активност, наречена кватернерна структура на протеина. Протеин с кватернерна структура, наречена epimolekuloy ilimultimerom. и нейните съставни полипептидни вериги - съответно субединици или протомери. Характерно свойство на протеини с кватернерна структура е, че отделна субединица не биологична активност.
Стабилизиране на четвъртичната структура на протеина възниква поради полярни взаимодействия между страничните вериги на аминокиселинните остатъци, разположени върху повърхността на субединиците. Такива взаимодействия здраво държат субединици, организирани под формата на комплекс. Много от субединици, в които се срещат взаимодействия, се наричат подложки.
Класически пример за протеин с кватернерна структура е хемоглобин. молекулата на хемоглобина с молекулно тегло от 68,000 Да се състои от четири субединици на два различни вида - # 945; и # 946; / # 945; Субединица се състои от 141 амино остатък киселина, # 946; - на 146. Висше sturkture # 945; - и # 946; подобни субединици, както и тяхното молекулно тегло (17,000 Da). Всяка субединица съдържа протезна група - хем. Тъй хем присъства в други протеини (цитохроми миоглобинът), които ще бъдат изследвани по-нататък, поне обсъждат накратко структурата на нишката (фиг. 6). Групиране е комплекс на хем една равнина пръстенна система, състояща се от централен атом, който образува координира връзки с четири пиролови остатъци, свързани с мостове метан (= СН -). желязо на хемоглобина обикновено е в състояние на окисляване (2+).
Четири субединици - две # 945; и две # 946; - комбинирани в една структура, така че # 945; подразделение в контакт само с # 946; субединица и обратно (фиг. 7).
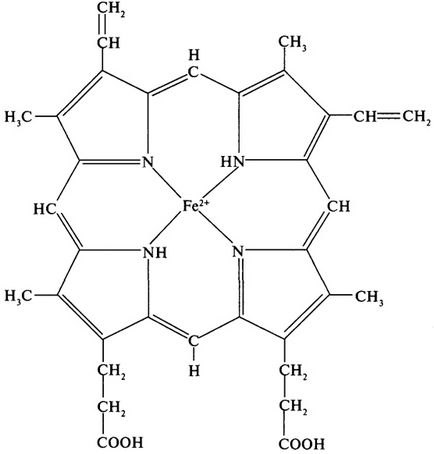
Фиг. 6. Структурата на хема на хемоглобин
Фиг. 7. Схематично представяне на четвъртичната структура на хемоглобин:
Fe - хем на хемоглобин
Както се вижда на фигура 7, една молекула на хемоглобина може да носи четири молекули на кислород. И свързването и освобождаването на кислород е придружено от структурни промени в структурата # 945; - и # 946; субединици на хемоглобин и тяхната относителна позиция в epimolekule. Този факт показва, че четвъртичната структура на протеина не е абсолютно твърда.
