Задача 1. Изчислява се концентрацията на водородните йони в разтвора HCN (Виж = 10 3 М) ако = 4,2 ∙ 10 -3.
Решение: Дисоциационните постъпления циановодородна киселина съгласно уравнението HCN ↔ Н + + CN -; концентрация йони [Н +] и [CN -] в разтвора равен на всеки друг (както N SN- + = 1: 1, където.
- стехиометрични коефициенти) т.е. [Н +] = [CN -] = Вж. мол / л; След това [Н +] = [CN -] = 4,2 ∙ 10 -3 ∙ 10 -3 = 4,210 -7 мол / л.
Задача 2. изчисляване на концентрацията на водородните йони и хидроксидни йони в rstvore NH4 OH, Виж концентрация = 0.01 М, ако Kd = 1,810 -5.
Решение: амониев хидроксид дисоциира, както следва:
NH4 ОН ↔ NH4 + + OH -. дисоциация има формата
концентрация на амониев йон [NH4 +] и хидроксид [OH -] съвпада ( (NH4 +): (ОН -) = 1: 1), за да ги определят за х:
[NH4 +] = [OH -] = х мол / л. След експресията на Cd става
1,810 -5 = X2 / 0,01-х. Ако приемем, че х <<См. решаем уравнение
1,810 -5 = х 2 / 0,01 х. х =
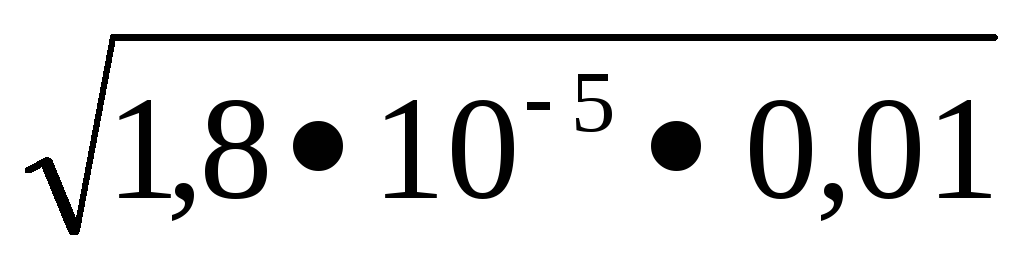
Концентрацията на водородни йони и хидроксид свързани чрез йонна продукт на вода KW = [Н +] [OH -] = 10 -14. изразяват водороден йон концентрацията на [Н] + = Kw / [OH -] и се изчислява стойността си:
[Н +] = 110 -14 / 4,210 -4 = 2,310 -11 мол / л.
Задача 3. Определяне на рН на разтвора от HCI ( = 1), ако CM = 2 ∙ 10 3 М
Решение: Дисоциация на солна киселина протича съгласно уравнението
HCl Н + + Cl -. Концентрацията на водородния йон [Н +] = Виж = 1 2 ∙ ∙ 10 -3 = 2 ∙ 10 -3 мол / л. РН = - LG [Н +] = - LG2 ∙ 10 -3 = 2.7.
Задача 4. Определяне на моларната концентрация на амониев хидроксид при рН = 11 и Kd = 1,8 ∙ 10 -5.
Решение: концентрация на водородни йони [Н +] = 10 - рН = 10 -11 мол / л. От йон продукт на вода определя концентрацията [OH -] = Kw / [Н +] = 10 -14 / 10 -11 = 10 -3 мол / л. Амониев хидроксид - слаба основа и се характеризира с уравнението на реакцията на дисоциация
NH4 ОН ↔ NH4 + + OH -. Експресията на константата на дисоциация
разтворимостта на продукта
Вещества, в зависимост от природата, имат различна разтворимост във вода, която варира от фракции на стотици милиграма грама на литър. Умерено разтворими електролити образуват наситени разтвори на много малки концентрации, така че може да се приеме, че степента на дисоциация достигне единство. Така, наситен разтвор разтворим електролит е система, състояща се от подходящ разтвор, в равновесие с утайката разтвореното вещество. При постоянни условия на околната среда скоростта на разтваряне равна на утаяване скорост процес на кристализация: Кн Am К ↔ п + m + m А - N (1)
За да се опише този процес използва хетерогенна равновесие константа на равновесие наречен разтворимост продукт PR = [К + m] н [А - п] м. където [К + М] и [A -п] - концентрация йон в наситен разтвор на (мол / л). Например:
AgCl = Ag + + Cl -. PR = [Ag +] [Cl -]; тук п = m = 1.
PbI2 = Pb 2+ + 2I -. PR = [Pb 2+] [I -] 2; тук п = 1, т = 2.
WP зависи от естеството на разтвореното вещество и температурата. PR е таблична стойност. Знаейки PR, може да се изчисли концентрацията на наситен разтвор на веществото и за оценка на нейната разтворимост в г на 100 мл вода (velichinas. Редуцируеми да Позоваването) и идентифициране на възможна загуба на вещество в утайката.
За уравнението (1) връзка наситен разтвор rastovrimogo твърд вещество със стойността на PR се определя от следното уравнение (Виж мол / л.):

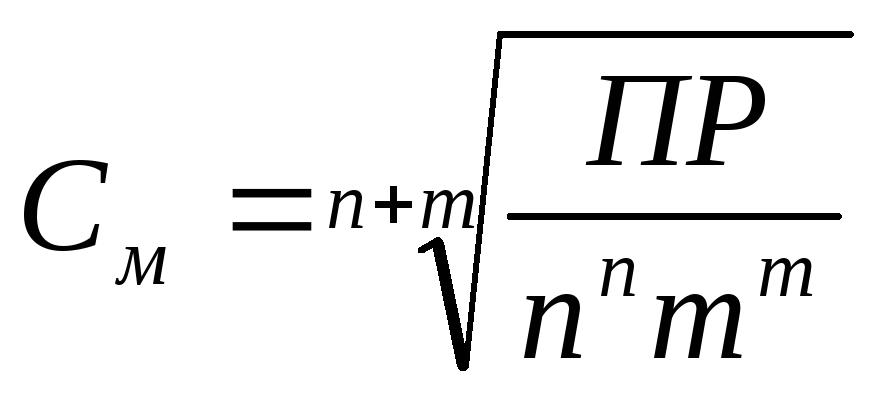
където п и m -stehiometrichekie коефициентите в Eq. 1.
Задача 5. Концентрация наситен разтвор (Виж) Mg (OH) 2 е 1,1 • 10 -4 мол / л. Напишете израз за PR и изчисляване на стойността му.
Решение: В наситен rastvoreMg (ОН) 2 равновесие е установено между утайката и rastvoromMg (ОН) 2 ↔Mg 2+ + 2ОН -. Региони за които експресия е PR = [Mg 2+] [OH -] 2. Познаването на концентрацията на йони, е възможно да се намери цифровата стойност. Като се има предвид пълна дисоциация
Mg (OH) 2, неговата концентрация наситен разтвор Виж = [Mg2 +] = 1,110 -4 мол / л, и [OH -] = 2 [Mg2 +] = 2,210 -4 мол / л. Следователно, PR = [Mg 2+] [OH -] 2 = 1.1. 10 -4 (2,2 10 -4) 2 = 5.3. 10 -12.
Задача 6. изчисляване на концентрацията на наситения разтвор и PR сребро хромат, ако в 0.5 L вода разтворима сол 0,011 грам.
Решение: За определяне на моларната концентрация на наситен rastvoraAg2 CrO4 използва formuloyCM =
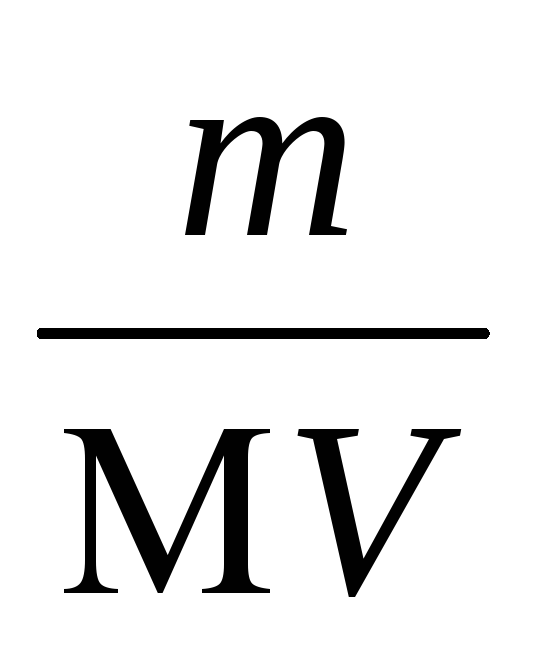
Така CR = (1,89610 -4) 2 (9,4810 -5) = 3,410 -12.
Задача 7. могат да се подготвят CaCO3 солеви разтвори с концентрации на СаСО3 С1 = 10 -2 М и С2 = 10 6 М. Ако PRSaSO3 = 3,810 -9.
Решение: Знаейки, стойността на PR, ние можем да се изчисли концентрацията
наситен разтвор на сол и се сравни с предложените
концентрации, за да се направи заключение за възможността или невъзможността за получаване на решения. Разтварянето на калциев карбонат протича през веригата СаСО3 ↔Ca 2+ + CO3 2- В този uravneniin = m = 1, тогава
С1> Виж - изготвя разтвор е невъзможно, тъй като е да се утаи;
C2 <См – раствор приготовить можно.
Реакционната йонообменна
За електролитни разтвори, характеризиращ се чрез взаимодействие на йонен обмен. Предпоставка за такива реакции протичат почти до края е да се отстранят от разтвора на различни йони, поради:
1) образуване на утайка
FeSO4 + 2 NaOH Fe (ОН) 2 + Na 2SO 4 - молекулярна уравнение (MU)
Fe2 + + SO4 2+ 2Na + + 2ОН - Fe (ОН) 2 + 2Na + + SO4 2 - йонна уравнение (IMD).
Fe2 + + 2ОН - Fe (ОН) 2 (OL Fe (ОН) 2 = 4,810 -16) - кратко-йонна уравнение образува утайка;
2) отделяне на газ
образуване на летливи съединения.
3) Получаване на слаби електролити
а) просто въпрос:
2K + + 2CN - + 2Н + + SO4 2- 2HCN + 2К + + SO4 2- (IMD)
CN - + Н + HCN (KdHCN = 7,8 • 10 -10) -ion молекулно Ур д elektrolitaHCN слабо образуване.
б) комплексни съединения:
Zn 2+ + 4NH3 [Zn (NH3) 4] 2+ - катион образуване на комплекс на кратко-йонна уравнение.
Има процеси, в които слаби електролити или слабо разтворими съединения между изходните материали и реакционни продукти. Равновесието в този случай се измества към образуването на вещества, които имат най-ниска дисоциационна константа или към образуването на по-малко разтворими вещества:
Равновесието е изместен към образуването на водни молекули.
B) AgCl + натриев йодид AgI + NaCl (MU)
AgCl + Na + + I - AgI + Na + + Cl -
AgCl + I - AgI + Cl - (IMD)
Равновесието е изместен към образуването на утайка с Agl.
B) процеси могат да се появят в уравненията и където има слабо разтворимо съединение и слаб електролит
MnS + 2Н + + 2Cl - Mn2 + + 2Cl - + Н2 S
MnS + 2 + Н Mn2 + + Н2 S (IMD)
PRMnS = 2,510 -10; [S -2] =
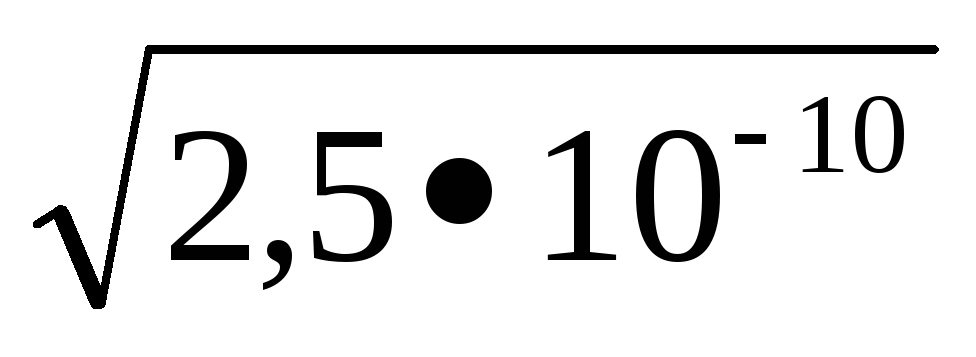
KdH2S = К1 K2 = 610 -22; [S 2-] =
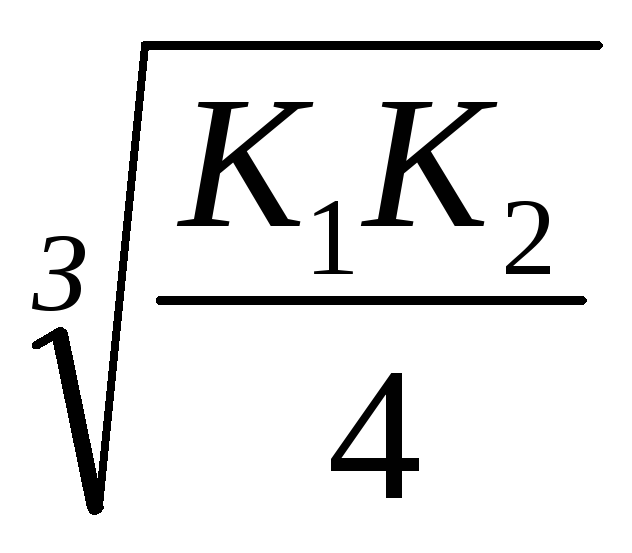
Свързване на S 2- йони в molekulyH2 Sproiskhodit-пълно от vMnS, така че реакцията протича в посока напред към obrazovaniyaH2 S
Хидролизата е резултат от взаимодействието между сол йони поляризация с тяхната хидратация обвивка. Хидролиза - е реакция на обмен между молекулите в разтвора на вода и сол йони. В резултат на хидролиза, поради образуването на слаб електролит (слаба киселина или слаба основа), равновесието на йони се променя O⇄N + H2 + OH - поради свързването на Н + или ОН - и рН на средата се променя. Хидролизата се подложи на соли, които съдържат слаба киселина или слаба основа йон. Соли, образувани с йоните на силни киселини и силни основи, не се подлагат на хидролиза (NaCl, Na 2SO 4). Продуктите на хидролиза могат да бъдат слаби електролити malodissotsiiruyuschie и пестеливо летливо вещество. Хидролиза - фазов отговор в случай на умножение зареден йон броя на стъпките, е равна на заряда. Претърпяват хидролиза pokationu соли с аниони на силна киселина и слаба основа катиони. Например, слаби основи са gidroksidyp - метали и D (Kd 10 -4) и амониев хидроксид.
Цинков хлорид - сол, образувана слаба основа Zn (OH) 2 и силна HCl киселина. цинковият катион има такса от 2+, следователно хидролиза ще се проведе на два етапа:
Zn 2+ + HOH ↔ ZnOH + + Н + I стъпка
ZnOH + + HOH↔ Zn (OH) 2 + Н + IIstupen
В резултат на това взаимодействие се появява излишък на Н + йони ([Н +] [OH -]). разтвор се подкислява (рН<7).
Хидролизата на аниона. Този тип на хидролиза е характеристика на солите, образувани с аниони на слаби киселини (Kd 10 -3) и силна основа катиони (Kd> 10 -3). Да разгледаме хидролиза калиев карбонат - сол, образувана слаб въглена kislotoyH2 CO3 (I = 4,5 KD от 10 -7.) И силна osnovaniemKOH, карбокси анион с заряд (2). Хидролизата се осъществява на два етапа:
В този случай, освободените йоните ОН - ([Н +] [OH -]) - Разтворът се алкализира (рН> 7).
Необратими хидролиза. Соли, образувани със слаба основа и слаба хидролиза на катиони и аниони киселина. В резултат на хидролизата зависи от стойностите на Kd на база и киселина. Да разгледаме хидролиза амониев флуорид - сол, образувана слаб
база NH4 OH (Kd = 1.8 10 -5.) и HF на слаба киселина (6.8 Kd = 10 -4.):
Свързани статии
