Получаване на солна киселина
Сглобяване на устройството, както е показано на Фигура 49.
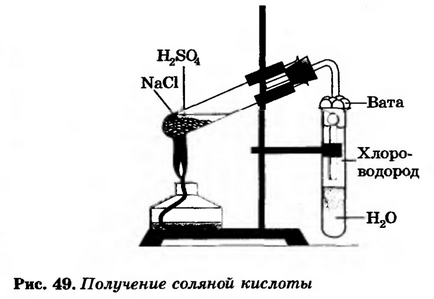
Леярската тръба 3,2 г натриев хлорид и приливът като концентрирана сярна киселина (2: 1) за всички солта се навлажнява. Затваряне на запушалката на флакона с изходен отвор за газ тръба. Долният край на тръбата към друга тръба с вода така, че е около 0.5-1 cm разстояние от повърхността на водата. След това сместа в първата тръба внимателно се загрява в продължение на 5-6 минути (правят се, че киселината не се размести във втора тръба с вода!).
1. Писане уравнения на химични реакции, настъпващи между концентрирана сярна киселина и натриев хлорид при нормални условия и при силно нагряване.
2. причината появата на втората тръба тънък спуска потоци?
3. Защо края на тръбата за обезвъздушаване трябва да бъде на разстояние от 0.5-1.0 cm от повърхността на водата?
Изследване на свойствата на солна киселина
Получената солна киселина се излива равномерно в шест епруветки. В първия тест потапяне лакмус епруветка. Вторият флакон се поставя парче цинк или магнезиеви стружки и трета - парче от мед. Четвъртата тръба пълнене малко меден оксид (II) и разтворът се нагрява. Петият епруветката се поставя някои прясно приготвен меден хидроксид (II), шесто на - малко креда или друг карбонат.
1. дали всички метали реагира солна киселина? Направи уравнения на реакции, настъпващи между солна киселина и горните метали.
2. Как можем да обясним образуването на четвърто и пето тръби сини решения, а шести - еволюцията на газ? Направи уравнението на съответните реакции.
3. Извършва се реакция признаване солна киселина и нейните соли. За тази цел, една тръба излива 1-2 мл разредена солна киселина, във втория - на същия разтвор на натриев хлорид, а третият - разтвор на калциев хлорид. Във всяка епруветка се добавят няколко капки сребърен нитрат. Проверка ако утайката се разтваря в концентрирана азотна киселина.
Добави извършени си уравнения реакции и посочва как могат да се разграничат: а) солна киселина и други киселини, б) хлориди от други соли, в) разтвори на хлориди от солна киселина.
Защо е възможно да се използва разтвор на оловен нитрат (II), вместо на сребърен нитрат (1) разтвор?
Получаване на солна киселина (HCl):

Изследване на свойствата на солна киселина:
За изследване на свойствата на солна киселина има няколко характерни за нейните реакции.


Свързани статии
