Интересът # xa0; химични трептения се определя от надеждата да се разбере механизма на периодични биологични процеси.
Проблемът е, # xa0 е, че днес ние нямаме никаква задоволителна математически модел за тези вариации, експериментално изследван достатъчно добре.
Целта на този документ # xa0 - подробно механизма на самостоятелно колебания хомогенна химична реакция Belousov-Жаботински (В-Е) в # xa0; цилиндрична чаша и # xa0; петриева паничка. За постигането на тази цел са изследвани теоретичните основи на самостоятелно люлеене в химични реакции; реакциите на B-F # xa0; цилиндрична стъклото и # xa0; блюдото на Петри; изучава механизма на самостоятелно колебания реакции B-F, самостоятелно осцилираща верига се конструират реакции B-F.
Универсалността на нелинейни динамиката го прави важно да се прави добър избор на лабораторни системи, # xa0; който може да учи и формирането на структура (самоорганизация). Към # xa0; такива лабораторни системи включват самостоятелно колебания хомогенна химична реакция, отворен # xa0 В. # xa0; AP # xa0; Belousov и # xa0; късно учи # xa0 А. # xa0 М. # xa0; Жаботински и # xa0; други учени.
Belousov-Zhabotinsky реакция # xa0 - то се провежда в # xa0; самостоятелно колебания режим каталитично окисление намаляване на бромна киселина NVrO3. Така се наблюдават колебания окислени и # xa0 концентрации, редуцирани форми на катализатор и # xa0 на; някои междинни съединения. Реакцията протича в # xa0; кисела среда (H2SO4), в # xa0 йони, използвани като катализатори променлива окисление церий Ce (SO4) 2: Ce3 + и # xa0; CE4 +. В # xa0; роля лимонена киселина действа като редуциращ агент ((НООС) С (ОН) (CH2COOH) 2).
реагенти бяха използвани за експеримента:
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 160 мг на лимонена киселина (НООС) С (ОН) (CH2COOH) 2 # xa0 - редуциращ агент;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 3 мг на сярна киселина (H2SO4) # xa0; - за създаване на кисела среда;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; Шестнайсетграм калиев бромат (KBrO3) # xa0 - неорганично съединение, сол на калий, алкален метал и # xa0; бромна киселина, безцветни кристали, лесно разтворим в # xa0; вода, е силен окислител, може да се използва в # xa0 както бакпулвер ( в някои страни е забранено) # xa0; - хранителна добавка E924; калиев бромат термично нестабилен, се разлага без топене, образувайки бромид и # xa0 кислород. Той реагира с # xa0; сярна киселина;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 3,5G цериев сулфат (Ce (SO4) 2) # xa0 - бял прах, безводен сол. Ion цериев сулфат [Ce (SO4) 24+] е силен окислител, особено в # xa0; кисела среда. цериев сулфат се използва като катализатор.
Експериментът се провежда, както следва: на електронна везна 16 гр бяха отмерена # xa0 калиев бромат (KBrO3) и 3.5 г # xa0; цериев сулфат (Ce (SO4) 2). Получава се разтвор на сярна киселина в H2SO4 # xa0; съотношение 1/3 дестилирана вода, лимонена киселина разтвор: а # xa0; стъкленица се прибавя 60 г # xa0; лимонена киселина се смесва със 100 мл дестилирана вода. След това, в # xa0; колба се смесват калиев бромат и # xa0; цериев сулфат # xa0 киселини (Фигура 1.).

Фиг. 1. Получаване на разтвори на лимонена (НООС) С (ОН) (CH2COOH) 2 (вляво) и # xa0 сярна H2SO4 (център) киселина, смесване на реагентите с # xa0 киселини (вдясно)
- # Xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; Detailing хомогенна самостоятелно колебания реакции B-F # xa0; цилиндрична чаша
В експерименти # xa0; цилиндрична чаша фиксирана периодична промяна на спектралната цвета на емисиите на разтвора от млечен (максимална концентрация [Ce + 3]), за да # xa0; тъмно оранжево (максимална концентрация [Ce + 4]) и # xa0; гърба, причинени от концентрации и вибрации окислени # xa0; редуцирана форма на катализатор Ce (SO4) 2 и # xa0; междинни съединения [Вг] (Фигура 2):

Фиг. Етап 2. Реакционната Belousov-Zhabotinskii (средни стойности са показани):
1 # xa0 - жълт (дължина на вълната, λ = 580 нм; честота, F = 520 THz; фотонна енергия E = 2.15 ЕГ)
2-оранжева светлина (дължина на вълната, λ = 590 нм; честота, F = 510 THz; енергия E = 2.10 ЕГ)
3 # xa0 - оранжево (дължина на вълната, λ = 620 нм; честота, F = 490 THz; фотонна енергия E = 1.98 ЕГ)
4 # xa0 - червен (дължина на вълната, λ = 750 нм; честота, F = 410 THz; фотонна енергия E = 1.68 ЕГ)
Преходът от стъпка 1 до # xa0; Стъпка 3 бе придружено от появата на разклоненията # xa0; - промяна на стабилно състояние на работа на системата # xa0 на; отделните точки разклоненията # xa0 - точки в системата на критичното състояние, в # xa0; който системата става нестабилен по отношение на колебания и # xa0, има несигурност: той е хаотичен и дали състоянието на системата ще се премести в нова, по-диференциран и # xa0; високо ниво на ред. Докато реакционните компоненти не прекарани такъв преход настъпва. Stochasticity в # xa0; този случай се съдържа в # xa0; вероятност за поява на бифуркационни точки.
наблюдава химическа реакция е екзотермична реакция, е придружен от освобождаване на топлина поради нарушаването на връзки, реакционни продукти образуване на връзка, което се отразява на спектрална цвета на емисиите на разтвора, и # xa0 е на фотонна енергия намалява от 2,15eV до 1.68 ЕГ.
Трептене период T # Xa0; ясно разделен на две части: T1 # Xa0 - фаза каталитично окисление фаза или увеличаване на концентрацията на [CE4 +] Етап 1 -4 -3. и # xa0; Т2 # Xa0; - намаляване на фазата на катализатор или фаза концентрация на падане [CE4 +] Етап 4 -2 -1. Тя е направена с # xa0; използване на експериментални данни. Имайте предвид, че T # Xa0; намалява с време от 1.5 до 0.6 минути (ris.3-4). След като всички реакционни компоненти са били похарчени, реакцията е спряна.
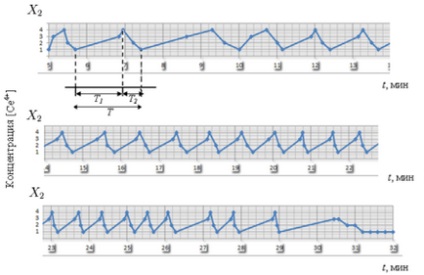
Фиг. 3. Периодът на осцилация T # Xa0; реакции B-F, който е разделен на две части: T1 # Xa0 - фаза на растеж [CE4 +] и # xa0; Т2 # Xa0 - фаза капка [CE4 +]
Получената Графиката показва експоненциална поведението на концентрацията на катализатор.
Получените модел модел отговаря тави # xa0 - Волтера # xa0 където концентрацията на С # Xa0; тя варира експоненциално, и # xa0; концентрация [Br -] # xa0; - линеен:
където: концентрация автокатализаторите [Ce + 3];
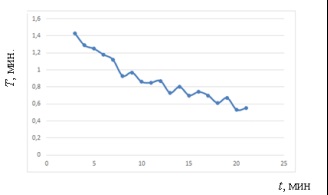
Фиг. 4. Промяна на периода T # Xa0; по време на експеримента
Период на промяна График T # Xa0; показва идентификацията на моделите # xa0; - намаляване на срока на неравномерно по време на експеримента.
Схематично изобразяват самостоятелно колебания механизъм на хомогенни реакции B-F # xa0; цилиндрична чаша (Фигура 5):
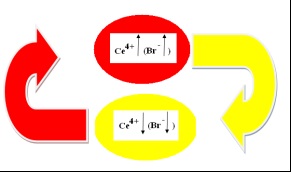
Фиг. 5. Механизмът на хомогенни реакции B-F autooscillatory
В първия етап на реакцията (червено овални, Т1) [Ce + 3] се окислява бромат. Концентрация [CE4 +] увеличава:
Когато горния праг на концентрацията [CE4 +] концентрация (инхибитор) рязко се увеличава, което води до # xa0; реакцията инхибиране. [] Взаимодейства с # xa0 активни частици и реакционната # xa0; с някои скорост изчезва от система, която помага да се намали концентрацията на [CE4 +].
Концентрация [CE4 +] намалява (жълто овална) достига долната прагова стойност, където концентрацията на [] намалява. След като концентрацията на инхибитора [] спадна, реакцията започва с # xa0; висока скорост: възстановяване на лимонена четиривалентен церий (НООС) С (ОН) (CH2COOH) 2 киселина:
След се повтаря този цикъл. По този начин, ние сме идентифицирали "часовник" реакции: [].
Недостатък на предложената схема е, че, от една страна, тя не съдържа # xa0; всички химични процеси, както и # xa0; разпределя само две основни и # xa0; второ, не съдържа математически модел на трептене модели.
За експеримента в # xa0; се използва петриева паничка разтвор, получен в # xa0; предишния експеримент, който се поставя тънък слой.
Налице е процес на авто-вълна, произтичащи от дисперсия на концентрацията на катализатор на повърхностни нехомогенности.
Този процес се характеризира с автоматично вълна пространствен и # xa0; времеви размери, независимо от първоначалните условия и # xa0; геометрични размери на системата.
Ние също така сме свидетели на промяна в спектралната емисия от жълто до # xa0; портокал, причинена от колебания в концентрацията на катализатор Ce (SO4) 2 и # xa0; междинни съединения от жълто до оранжево (Фигура 6). Промяна на концентрацията [Ce + 3] и [CE4 +] не настъпва синхронно през разтвора поради кос колебанията в # xa0; отделните точки разтвор максимуми настъпи неравномерно # xa0; различни части от разтвора.
По този начин, ние наблюдаваме периодични окисления пътуващи вълни, произтичащи от нехомогенност (част с # xa0; модифицирани параметри). Скоростта на разпространение е постоянна и окислителни вълни # xa0; определя от свойствата на пространството и # xa0; повторение период # xa0, - параметри в # xa0; част нехомогенност.
Фиг. 6. Промени в структурата на autowaves # xa0; реакции B-F # xa0; петриево блюдо
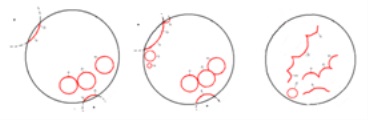
Фиг. 7. Схематично представяне на промяната на фронта
Когато това се случва благодарение на местната синхронизация среда киселинност или концентрация на бромат. Нека A # xa0 и В # xa0 - киселинност (А) и # xa0; увеличаване на концентрацията на бромат (В); C # xa0 - сблъсък точка на първата вълна A # xa0 и В; D # xa0 - улавяне # xa0 The; вълни, идващи от А; F # xa0 - пълно изчезване на колебанията на фаза (Фигура 8).
Фиг. 8. Околна среда Синхронизация: абсорбцията на вълна от друг
След концентриране на реакционните компоненти, и # xa0, а именно, концентрацията на идентифицираните "часовник" реакции: [] е бил използван до, реакцията спира.
Така, въпреки различните условия на експеримента поток # xa0; цилиндрична бехеровата чаша и # xa0; петриево блюдо: а # xa0; първия случай се инициира процес на самоорганизиране са бифуркации, втората # xa0; - дисперсия на концентрацията на катализатор на повърхностни нехомогенности в # xa0; двата случая открити "часовник" реакции: [] # xa0; - бромни йони, наличието на необходимата стойност, която е основният но не единственото условие за стартирането на самоорганизация. В # xa0; System Tray "ловец-плячка" тези "часовник" е храната за жертвата, ако храната не е достатъчно # xa0 - овце умират, и умират # xa0; вълци. Ако фуражът е много # xa0; - Вълци пренаситен, спрете на лов в # xa0; тяхната опаковка йерархия ще обменят закони ... Т. # xa0; д. има универсалност на законите на самоорганизация!
Основни понятия (генерирани автоматично). чаша и петриево блюдо, в цилиндрична чаша и чаша реакции B-F, самостоятелно колебания реакции B-F, сулфат на церий, концентрация на катализатор, реакционните компоненти, химична реакция, лимонена киселина, окислителен катализатор фаза реакции B-F в цилиндричен, калий и цериев сулфат, механизмът за реакция на самостоятелно колебания, Т1 - фаза, и Т2 - фаза, калиев бромат, фаза на растеж, попадащи фаза, увеличение концентрация фаза, фаза капка концентрация.
