Московската медицинска академия. IMSechenov
Рискови фактори за АД
Според съвременните концепции, BP - многофакторно заболяване, развитието на която е тясно свързана с генетични дефекти на имунната реакция и негативни влияния на факторите на околната среда. Установено е, че ефектът от тези фактори определя темпото на развитие на АД, особено при малки деца, и колкото по-скоро започва въздействието на тези фактори, по-рано е проява на АД [4, 6].
Генетично предразположение към алергия, че ние открихме, в 82% от случаите, е водещ фактор, и се определя от функции генетично програмирани системен имунен отговор към антиген, както и нарушения на генетичен контрол на производството на цитокини, особено интерлевкин-4 (IL-4), което е придружено от увеличаване на производството на IgE, и генерализирана свръхчувствителност [7]. Генетично причинена и местни механизми на кръвното налягане, което се характеризира с голям натрупване на Лангерхансовите клетки в кожата на болни деца, изграждане модификации и разпределение в епидермиса на тези клетки, увеличаване на броя на високо афинитетни рецептори на техните мембрани и намаляват роля в поддържането на митотичен активност на кератиноцити, което засилва хиперпролиферативни процеси в епидермиса , Генетично също се дължи на значителния брой eozinofilov- "дълголетен" устойчиви на апоптоза, като така се увеличава циркулацията на кръвта в период до три месеца (макар че на живо обикновено не повече от 1 месец); едновременно открива също присъщо детерминирана синтез патология липид, което води до дефицит на церамид и подобрена сухота на кожата, нарушава нейната функция бариера [7, 8].
При изпълнението на генетично предразположение към развитието на АД също са включени множество екологични фактори:. Висок антигенен товар върху плода по време на бременност, майките пушачки, ранно изкуствено хранене и ранно въвеждане на допълнителни храни и продукти, които не отговарят на възрастта на детето [4]
Съществен фактор на риска от AD е патологията на стомашно-чревния (GI) тракт, особено чревната дисбиоза (89%), като нормалната чревна микрофлора играе важна роля в развитието на имунната система на бебето и има защитен ефект в образуването на атопия. Са важни като нарушения на екологията, местообитание, и микросредата на детето. Тези фактори се проявяват в определени периоди възрастови и образуването е придружен от неблагоприятната комбинация от различни форми на БА при децата.
Причинно-значителен алергените в BP са предимно хранителни алергени, които са най-често се откриват в малки деца (според нашите данни, в 94-100% от случаите). По същество хранителна алергия е началната чувствителност, срещу която се образува от реакции на кръстосано свръхчувствителност към други алергени. Доминиращата роля на хранителна алергия постепенно намалява с възрастта на детето и нарастващото значение аероалергенти предимно местни (38%), епидермален (35%), цветен прашец (32%), бактериални алергени (20%), постоянното действие, което улеснява повтарящ се разбира BP [3 4].
Сред бактериални алергени с AD инсталиран значителна роля на Staphylococcus Aureus, което е 80-90% от основния микроорганизма колонизира засегнатата кожа и секретират екзотоксини суперантигени със свойства, които инхибират апоптоза и стимулират пролиферацията на Т-лимфоцити, който ускорява chronization алергична кожа възпаление [ 8, 9].
Патогенезата на АД
Патогенезата на AD са имунни механизми с водеща роля на Т лимфоцити и Лангерхансовите клетки. Сега е установено, че механизмите на образуване на BP водещ имунен отговор е бифазно поляризацията, причинени от известните Т-лимфоцити [7]. Освен това беше установено, че Лангерхансови клетки са основните клетки на имунната система на кожата, отговорен за IgE-медиирана натрупване на алерген в кожата, както и тяхното представяне на Т-лимфоцити, както и броя на пациенти с БА са значително по-високи, отколкото в здрави контроли [10]. В това виждам една от причините за Преобладаващите кожни лезии при деца с АД. През последните години, Лангерхансовите клетки се считат за специализирани vysokopotentnye антиген-представящи клетки на кожата, отговарящи за развитието на острата фаза на алергично възпаление на кожата и да преминете на имунния отговор към Th2. В първия контакт с антигена се свързва с висок афинитет рецептори IgE (FceRI), които са разположени върху повърхността на Лангерхансовите клетки, те претърпяват ензимни алергени разграждане и се свързват с HLA клас II антигени. Полученото където полипептидът специфично се разпознава от Т клетъчен рецептор на CD4 + лимфоцити. След получаване на информацията, Лангерхансови клетки мигрират в лимфните възли, където взаимодействат с ТН0-лимфоцити, като по този начин увеличаване на активирането на Т-клетките помощници, насърчава ги превключване настрана и се придружава от увеличеното производство на Th2 цитокини. Така Тп2-хелперни клетки секретират предимно интерлевкин (IL-4, IL-5, IL-10, IL-13) и активирани В лимфоцити от местната хиперпродукция специфичен IgE. При повторно въвеждане на алергена се неговото свързване към специфични рецептори на мембраната на мастните клетки, което индуцира процес на дегранулация с освобождаването на възпалителни медиатори и хемокини, които предизвикват ранна фаза на алергични реакции е клинично проявява силен сърбеж, еритема, кожни обриви.
Под действието на медиатори на острата фаза на БА са включени в епидермиса, епителни възпалителни дендритни клетки, които също са антиген отговорен за хронична фаза на образуването на кръвното налягане, характеризиращ се с включване на имунния отговор към TH2- на Th1-лимфоцити с повишена продукция на интерферон-г (IFN-G), IL 2 и IL-12, насърчаване на хроничен алергичен процес в кожата [10]. В допълнение, цитокините IL-5, IL-6, IL-8 увеличаване на миграцията на еозинофили и макрофаги във възпалителния фокуса, което определя степента на хронично алергично възпаление на кожата. Освен това, при хронични AD еозинофили са от особено значение "дълъг живот", които са по-малко податливи на апоптоза и произвеждат високи нива на еозинофили основен протеин.
В допълнение към имунни механизми в патогенезата на AD, имат стойност от увреждане на роговия слой и вода липидния филм се дължи на алергично възпаление. Освен това, в случай на повреда на вода-липидния филм се увеличи значително трансепидермалната загуба на вода, което води до тежка суха кожа, висока чувствителност към дразнители, бактериите се размножават и натрупване на антигени. Повишена сухота насърчава сърбеж поддръжка и сърбеж и чесане, последвана от допълнителни щети кератиноцити и мастни клетки, който подобрява качеството на алергично възпаление на кожата в АД. Когато надраскване инфекция на кожата увеличава патогенни флора, за предпочитане стафилококус ауреус, което инхибира апоптоза и подобрява пролиферацията на Т-лимфоцити, които също допринася за хронично алергично възпаление на кожата [10, 11]. Освен това, през последните години, е настроен autoallergenov освободен от възпалителни промени в тъканите, особено по време сресване, които поддържат имунен отговор, който се причинява главно от алергени околната среда [10]. Той играе роля като дисфункция на централната и автономната нервна система на пациентите от невропептиди, който контролира активността на имунокомпетентни клетки и участва пряко в механизмите на образуване на сърбеж с АД при деца (фиг. 1).
Патофизиологичен промени по време на кръвното налягане се намира в това, че в алергично възпаление на кожата при пациенти с редица функции и се характеризира с неспецифична хиперреактивност на различни стимули и антигени, повишена сухо, десквамация физиологични разстройства епителен удебеляване на роговия слой с развитието на хиперкератоза и изрази лющене.
Фиг.1. Схема АД патогенеза.
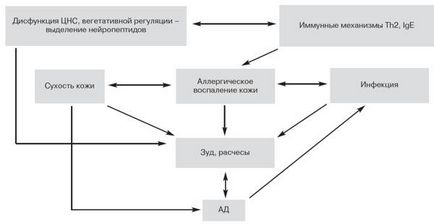
Таблица 1. Анти-възпалителни агенти за локално лечение на AD
Фиг. 2. Диагностични критерии за реклама.
• Сърбеж на кожата
• Възраст морфология на лезии
• Възраст постановка
• Типични локализация
• Един ранен старт
• Хронична повторно влошаване
• История на семейството
• неспецифична хиперреактивност на кожата
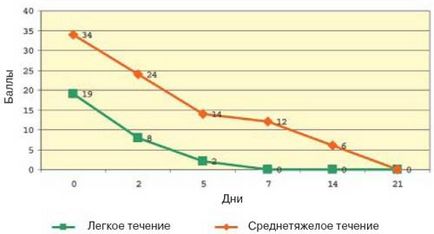
Фиг. 3. Динамика на симптоми на кръвното налягане (чрез оценка на SCORAD) по време на лечение с Elidel.