Бази са съставени от положително заредени метални йони и хидроксилни йони ОН. Луга - основа, които са лесно разтворими във вода.
Информация за разтворимост във вода може да бъде взета от масата за разтворимост. P - разтворима основа, който е алкално, т - слабо разтворим, п - неразтворим ада "-" означава, че една база не съществува.
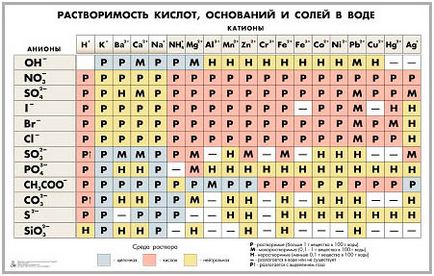
При нормални условия, те са твърди вещества. Те са под формата на бял прах, лесно поглъщане на влага. Изискване за съхранение в банките на дебело стъкло с широко гърло или пластмасови контейнери.
Получаване бази
Алкално образуван от реакцията на метала и вода с голямо отделяне на топлина.
2Na + 2H2O> 2NaOH + Н2
СаО + H2O> Са (ОН) 2.
Натриев и калиев хидроокис са образувани под действието на електрически ток разтвор:
KCl + 2H2O> 2KOH + H2 + Cl2.
свойства на бази
основи реагират
1. киселинен оксид:
2KOH + SO3> K2SO4 + H2O.
Алкално може да разтвори алуминиев оксид филм (амфотерен оксид):
2. киселини:
NaOH + HCl> NaCl + HOH.
Можете да се определи дали има някакви основи, ако добавите 1-2 капки разтвор на фенолфталеин. Луга е реагирал напълно, ако цветът пурпурно на разтвора не се появи.
Реакцията между основата и киселина - реакцията неутрализация. Такива реакции са често използвани за пречистване на отпадъчни води от промишлени инсталации основи и киселини. Продуктите от тези реакции - солите, които са по-безопасни за околната среда. Много ефективен и рентабилен е да се неутрализира отпадните води от различни индустрии.
3. соли. Този обмен на реакцията. Появят в разтвор, началната сол трябва да бъде разтворимо във вода. Вещество получени - неразтворим:
2NaOH + Mn (NO3) 2 = Mn (ОН) 2v + 2NaNO3
4. халогени.
В студени условия: Cl2 + 2NaOH = NaClO + NaCl + H2O.
При нагряване: 3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O.
Melt може само натриеви и калиеви хидроксиди (топене съединения точка са 322o и 405o, съответно).
Безопасност при работа с основи
Химически изгаряния, причинени от основи, включително натриев хидроксид и калиев хидроксид, са много по-опасно от химически изгаряния от киселини. Burn се увеличава, ако парче от кристален материал се придържа към кожата.
Алкално да корозират много материали, да причини тежки изгаряния на кожата и лигавиците, поразително очи. Следователно, натриев хидроксид се нарича "сода каустик" и калиев хидроксид -. "Калиев хидроксид" Когато се работи с основи и техните решения трябва да бъдат внимателни. След контакт с алкален разтвор на кожата, е необходимо да се изплаква обилно с вода. След обработване на това място слаб разтвор на оцетна киселина или борна киселина. И отново се измива с вода.
Какви неща "амоняк"?
Течност, озаглавена "амоняк" - е воден разтвор на NH3 амоняк газ. Той се използва като лекарство. В течен амоняк, съдържащ база NH4OH (амониев хидроксид). Образувани чрез реакция:
NH3 + H2O- NH4OH.
Взаимодействие влиза малко количество разтворен амоняк и едновременно разчупва изходните материали, както е показано със знак "-" във формулата. Амониев хидроксид, алкално като, променя оцветяването на индикатора взаимодейства с киселинен оксид, киселини и соли.
2NH4OH + CO2> (NH4) 2SO3 + H2O
NH4OH + HCl> на NH4CI + H2O
NH4OH + Pb (NO3) 2> Pb (ОН) 2v + 2NH4NO3.
Използването на бази

Амонякът се използва не само за да доведе човек в ума. Може да се използва за перфектно измиване на прозорците, като се използва 1 супена лъжица на 1 литър вода. След това е необходимо, за да избършете с хартиена кърпа.
Ако смесите една част амоняк и 1 част оцет и след това избършете повърхността на разтвора на желязо, получено, то ще бъде чиста. Но не мисля, че ще незабавен ефект. Повърхността трябва да бъде внимателно разтърка.
Широко използвани, по-специално натриеви и калциеви хидроксиди. Гасена вар - калциев хидроксид е Са (ОН) 2. Той се използва като свързващо вещество в строителството. Смесени с пясък и вода. Получената смес се прилага на тухли, мазилка. В резултат на взаимодействието на основа с въглероден диоксид и силициев оксид (IV), сместа се втвърдява. Вар е в състояние да абсорбира киселинните газове. Той може също да абсорбират токсичните вещества, така че здравето на жителите избелване на стаята, а не боя.
Калциев хидроксид се използва в производството на захар, в селското стопанство, в производството на пасти за зъби, получаването на много вещества.
Натриев хидроксид (сода каустик), използвани в производството на сапун в реакционната алкална на с мазнини при производството на лекарства в дермалния промишленост да очисти нефт. Сода каустик се използва за почистване на мазни петна. Всички известни тръба "мол" е разтвор на натриев хидроксид може да разтвори грес и дори косата.

Алкално ецване стъкло и порцелан. Разтворен протеинови вещества.
Използва се в медицината като антисептици, дразнещи и разяждащи продукти. При заболявания на храносмилателната система са алкална минерална вода ozdoravlivayusche. Ефективни при лечението на подагра, стоматит, при лечението на заболявания на дихателната система. Тя е диуретик. Неутрализира киселина отравяне.
Значително основи част в производството на каучук, синтетични влакна, багрила, почистване на метални предмети, обработката на дървени повърхности. Има хладилен чилъри. Използва се в селското стопанство, леката промишленост и металургия.
Алкалните храни
Разграничаване киселинни, алкални и неутрални храни. Сред алкални продукти могат да бъдат изброени зеленчуци, ряпа, краставици, хрян, целина, лимони, цвекло, моркови, зеле, цитрусови, къпини, грозде, череши, сушени плодове, картофи, чушки, домати и чесън.

Трябва да се отбележи, че в неутрални продукти, съдържащи и киселина и основа. Този зеленчук масло.
Интересното е, че млякото - е алкален продукт. Но топло мляко или варено - кисел продукт.
Основи са широко използвани от човека. Трябва да се помни, и без да успеят да се съобразят с правилата за безопасност.
Свързани статии
