
Начало | За нас | обратна връзка
В природните води е не една, а няколко окислително-редукционни реакции. Тези реакции са свързани с наличие elemenov които са в състояние да промени своята такса в зависимост от електрическия потенциал на разтвора. Следователно, редокс потенциал на разтвора като цяло се определи естеството и концентрацията на тези елементи. Тези компоненти, които оказват съществено влияние върху редокс potentsialrastvora нарича електроактивни. Елементи, концентрацията и форма на съществуване, които всъщност контролира окислително-RECOVER-pheno- потенциал разтвор, наречен е даден потенциал. В естествени води, като може да бъде О, S, С, К и Fe. Разтвори, които съдържат относително високи концентрации на тези компоненти и следователно почти никаква стойност промяна на окислително-RECOVER-кандидат-ЛИЗАЦИЯ капацитет чрез прибавяне на окислител или редуциращи агенти, наречени редокс буфери.
редокси потенциал на разтвора като цяло може да се определи по три начина:
1- концентрации на отделните компоненти на редокси двойката,
2- директно чрез стандартен водороден електрод, и
3 на относителното съдържание на електроактивни компонент в разтвора.
1. В първия случай, редокс потенциал се определя от относителните концентрации на компонентите на една двойка rodeks. Обикновено такива двойки избрани между преходните метали, най-често Fe 3+ и Fe2 +. Тези метали не винаги са в състояние да попитам, но те са сравнително бързо достигане на равновесие концентрации, определени от решение Eh стойност. Този метод Eh оценка стойност е показано в Пример II-6.
В прясна вода намерена 10 -3.3 мола / л Fe2 +. и 10 -5.9 мола / л Fe 3+. Необходимо е да се определи стойността на решение Eh.
Да приемем, че концентрацията на железни йони са балансирани. Те си взаимодействат съгласно реакцията на половината: Fe3 + + Е - = Fe 2+. стандартен електрод потенциал на тази реакция е 10 LG KFE = -13, Зе = 1. В прясна вода коефициенти на активност може да се приравни на 1.
Има две възможни решения.
Метод 1: Когато уравнението на равновесие е валидно:
.
След това. Ех = 0059 # 8729; 10.4 = 0.61 V.
Метод 2: Съгласно уравнението Нернст
= 0,771- 0059 LG (10 -3.3 # 8729; 10 +5,9) = 0,77- 0,15 = 0,62 В
Следователно вода има редокс потенциал на 0,62 V, което е 0,15 V по-ниска от тази, изисквана за равновесие. Този разтвор се подлага на електронен дефицит е окислителя.
Въпреки редокс реакции протичат при различни скорости в разтвора, стойността на който често зависи от съдържанието и характера на микроорганизмите. Най-бързият счита реакция редокси между металите (например, Fe2 + 3+ ↔Fe. ↔Sn Sn 2+ 4+ и т.н.), полуживот се измерва в минути или часове. Redox реакции с аниони, по-специално органична материя, включваща O2 и хидролиза са значително по-бавно. Това се дължи на факта, че тези реакции имат високи активиране енергии, които са свързани с разрушаването на силни ковалентни връзки. Много от тези редокс процеси в естествени условия се реализира само чрез биохимичен катализатор (например, N2 → NO2 - → NO3 -). Скоростта на тези процеси са много ниски и нестабилни: микробните популации трябва да се адаптират към околната среда и да влезе в пряк контакт с окислително-редукционни двойки. Само окисление сулфидна сяра в алкална среда може да се дължи на сравнително бърз процес. Много окислително-редукционни реакции са твърде бавни, поради константите изключително високи равновесие и необратим по същество. Периодът на полуразпад на тези ефекти могат да бъдат няколко години. За тази определена стойност EH окислително-редукционни двойки рядко могат да бъдат критерий за редоксипотенциалът от решението като цяло.
Въпреки това, този метод се използва за определяне на редокси потенциал на буфера, които обикновено експресират величината на летливостта на равновесие кислород. В този случай, кислород се използва като донор на електрони в редокс реакции. След това реакцията на окисление на желязото е както следва:
и окисляването на сяра:
Тук дейността на кислород се използва като индикатор или индекс на окислително-редукционни условия, независимо от това дали има кислород в системата или не. При условия на равновесие, като последният реакцията е дейност, свързана със стойността на константата на равновесие:
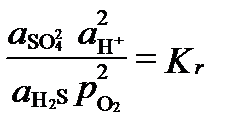
редокси потенциал на това равновесие ситуация може да се изрази с кислород летливостта на количество, което, когато Кр = 10126 и рН = 7:
Обикновено redoeks буферен капацитет определя от формата елементи съотношение minearlnyh с различни окислителни състояния. В седиментни скали като индексът използва реакция превръщане на магнетит на хематит:
Окислителни условия по отношение на утаяване и diagenesis harakerizuetsya кислород летливостта обикновено от 0.2 атмосфери до повърхността 10 -70 атм при стандартни условия.
2. Определяне на Eh на разтвора, като се използва стандартен водороден електрод е по-надежден. В този случай, редокс потенциал се определя директно във вода, той се сравнява със стандартно потенциал водороден електрод. чиято величина се приема да бъде 0. апарат електрод е показано на фиг. II-8
Фигура II-17. принцип разтвор Eh Сравнението на със стандартен потенциал водороден електрод. Тестов обект вода, В - стандартен водороден електрод.
Ех с магнитуд, измерена по този начин, се характеризира със средно отклонение, а не непременно балансиран, сграда # 8710; Erastv. разтвор изцяло от стандартната потенциал водороден електрод:
Трябва да се има предвид, че в действителния потенциал на водородния електрод не е равно на 0. Неговият потенциал се определя от уравнението:
Ако E 0 H = 0,0 V, а = 1 атмосфера, след което:
коефициенти за дейността на конвенционални киселини са добре проучени. Следователно, при температура от 25 ° С и 1 атм:
Това уравнение характеризира корекцията, която е обикновено автоматично взема предвид и намалява грешката при определяне на Eh на рН на разтвора се дължи на нестабилността на електрод водород.
Освен това, когато се измерва Eh eletrodom необходимо да се вземе предвид ефекта на взаимодействие с вода електрод oprobuemoy, а именно нейното корозия или адсорбцията на частици на повърхността си. Например, когато е потопена в богата аноксична вода Fe2 + електрод O2 адсорбиран върху повърхността им може да се утаи FeOOH, което оказва значително влияние върху нейната electroactivity. Измерванията електрод Eh най-надежден метод в изследването на кисела вода с високи концентрации на Fe2 + и Fe3 +.
Стойности Eh, измерена с използване на стандартен електрод съдържа известна несигурност. Очевидно е, че разтвори с по-голяма величина Eh действа като окислител по отношение на разтвори с по-малка величина Ех. Но това не означава, че всички от редокс реакция разтвор са в равновесие, и имат една и съща стойност на потенциала за редокс.
Поради тази причина стойности Eh (РЕ), изчислена за различни rodeks двойки на същите методи разтвор и електрода предлага широк обхват от стойности. В повечето случаи, получените от електрода резултатите, лоши резултати са сравними с тези, получени чрез rodeks двойки. Това е показано на фигура II-9, където стойностите а, измерени в метода на електрод се сравняват със стойностите на Eh, изчислени rodeks двойки.
Основната причина за този вариант е липсата на естествените води в пълно равновесие на окислително-редукционни реакции. Следователно стойност метод Eh електрод, като правило, не може да се дължи на всяко конкретно редокси двойки и се използва за интерпретиране на взаимодействието на неговите компоненти. Изключение може да бъде случаят, когато се използва електрод е чувствителна само на една двойка rodeks. Обратно, Eh стойност, изчислена чрез концентрацията на отделните редокс двойки могат да бъдат използвани за характеризиране на редокси потенциал на разтвора като цяло.
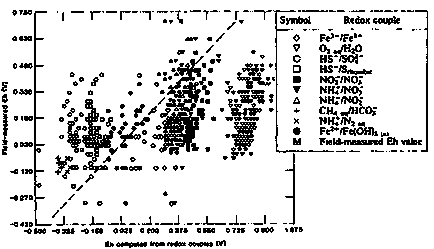
Фигура II-18. Сравнение на поле на електрода EH измервания в подпочвените води с потенциал изчислени от отделните двойки rodeks на (Lindberg, R.D. Runnells, D.D. 1984).
3. И накрая, редоксипотенциалът на разтвора може да се изчисли, ако знаем всички окислително-редукционни двойки състава му и позволи на своя пълен химичен равновесие.
Всъщност, ако има J rodeks реакции, които се появяват едновременно и изискват най-ве, й електрони действат върху всеки обмен, общият брой на електроните, които участват в процесите на редокси-RECOVER-VI-ващи разтвор, както и. Тогава максималната нетна работна всички galvanichesih микроелемент решение, в съответствие с уравнение II-149, е равен на:
В същото време, минималната свободна енталпия на всички тези реакции, според Уравнение II-91, е равна на:
и където - стойности на стандартни потенциала на моларното свободен енталпия на реагентите и продуктите на редокси реакции - минималното свободно енталпии на тези реакции на равновесие, ве, J - брой на електрони, участващи в тези реакции. Сравнявайки последните две уравнения, получаваме:
СО2 + 2Н + + 2е = СО + Н2 О (= - 0104 V)
CO + 2Н + + 2е = С + Н2 О (= 0518 V)
СО2 + 4Н + + 4е = С + 2Н2 О (= (2 х 0,518-2 х 0.104) / 4 = 0,207 V)
Количеството характеризира обща редокси потенциал на разтвора по отношение на нейната пълна химическа равновесие. Все пак, това равновесие в природните води, като правило, не се дължи на големите разлики в процента на редокс реакция. Ето защо, за да се оцени реалната стойност Ehrastv. разтворът трябва да се вземе предвид реалната дейност (концентрация) на компоненти, участващи в окислително-редукционни реакции ratvora. След това, според уравнения II-150 и II-153 разтвор а като цяло е:
Свързани статии
