Електрически заряд чрез електролиза
Оборудване: източник на постоянен ток, клетка с електроди от набор от "електролит" лаборатория волтметър, резистор везни с тежести или електронен ключ, свързващи проводници, се прибавя разтвор на меден-ку Poros, хронометър (или часовник с втора ръка).
БЕЛЕЖКИ да работят. може да използва правото на електролиза на Фарадей за определяне на таксата електрон, където m - маса на дадено вещество освободен на катода; М - моларен маса на веществото; п - валентността на веществото; д - заряда на електрона; Na - Число на Авогадро; I - ток в електролита; # 8710; т - време на протичане на ток през електролита.
От тази формула е ясно, че целта на работата, която трябва да знаете п молекулна маса вещество освободен на катода, неговата ол-ин и равностойността на константата на Авогадро. В допълнение, по време на експеримента, трябва да се измери силата на тока и към момента на тяхното възникване, а след електролизата - много вещество, се развили на катода.
За експериментите с помощта на наситен воден разтвор на меден сулфат, който се излива в клетката с две елемент мед ktrodami. Един електрод се фиксира неподвижно в центъра на клетката, а другата (разглобен) - на стената му.
Водният разтвор се дисоциират молекули не само меден сулфат (CuS04 = Cu2 + +), но също така и вода (Н20 = Н + + ОН -), макар и в по-малка степен. По този начин, във воден разтвор, съдържащ CuS04 положителни йони Си2 + и Н + и отрицателни йони ОН и SO2-. Ако между електродите за създаване на електрическото поле, положителните йони ще се придвижват към катода, а отрицателната мащаб - към анода. Към катод подходящи йони Си2 + и Н +, но не изпълнява всички от тях. Това е така, защото медни атоми и водородът лесно прехвърлени на положително заредени йони, загуба на външните електрони. Но медни йони лесно отдава електрони от вида на основната йон вода. Следователно катода освобождава медни йони.
За анода ще се движат отрицателни йони и ОН, но никой от тях няма да бъде приключен. Когато започне да се разтваря мед Xia. Това е така, защото медни атоми по-лесно даряват електрони към външна част електрическа верига от йоните и OH -, и стават положителни йони ще преминат в разтвор: Cu = Cu2 + + 2e-.
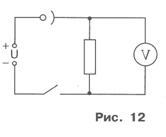
За утаеният меден слой е плътен и добре се държи при катода, се препоръчва електролиза се извършва в не-високото съдържание в разтвора. И тъй като това ще доведе до по-голяма измерване греховност, вместо амперметър в лабораторията, като се използва резистор и волтметър. С посочване на волтметър U и ко-резистентност резистор R (изглежда по тялото му) се определя в B-LU ток I / схематична диаграма на експериментална настройка е показано на Фигура 12.
Токът в електролита по време на експеримента може да варира, следователно формула за определяне на зареждане под-stavlyayut 1 SR нейната средна стойност. Средната стойност на тока се определя чрез регистриране на всеки 30 секунди на волтметър показания Дължина-SRI целия период на наблюдение, след тяхната сума-miruyut и получената стойност се разделя на броя на измерванията. Така че намери НТП. След това, по закона на Ом за вторична верига са ПС. Vo лед-B напрежение измервания по-лесно да се въвеждат в помощното ING маса.
текущото време поток измерва хронометър.
ПОДГОТОВКА ЗА РАБОТА
1. Посочете какво физически количества подлежат на директно измерване за определяне на метода на електронен заряд, използван в тази работа. С помощта на някои инструменти, ще се измерва? Отчита и се записва на границите на абсолютни pogreshnos-Дрен на тези устройства.
2. отчита и се записва на границите на абсолютните грешки, които референтна рамка, с помощта на механичен хронометър, волтметър и тежести.
3. Напишете формула за определяне на границите на абсолютен грешник-ност # 8710; д.
4. Изготвяне на таблица за отчитане на резултатите от измерването и грешки, за да се изчисли-ции.
Подгответе спомагателни таблицата за отчитане на показанията на настоящите метра.
Отговори на въпроса
Защо е времето на протичане на ток в електролита се отразява резултата от грешник-ност за измерване на таксата за електрон?
Тъй като концентрацията на разтвора влияе върху резултата от измерване на електрон-серия?
Каква е валентността на мед?
Какво е моларната маса на мед?
Какво е Числото на Авогадро?
Ред на изпълнение
1. Определяне на теглото на скали подвижен Т1 електрод.
2. Поставете електрод на клетката и монтаж на електрическата верига е изглежда на Фигура 12. Забележете, че електродът има подвижен Xia свързан към отрицателния полюс на източника на напрежение.
3. Напълнете кюветата с разтвор на меден сулфат, заключване на ключа и на всеки 30 секунди за 15 минути записват показанията на ток-метъра.
4. След 15 минути отворите ключ разглобява верига и премахване на електрода, и се определя суха маса м2 с мед се отлага върху него.
5. Изчислете тегло на медна утайка: Т- чужбина и аб са абсолютни грешка на измерването му # 8710; т.
6. Изчислява се средната стойност на напрежението в резистор USR и средния ток I в електролита ср
7. Compute електронна заряд на електрона.
8. Изчисли граница абсолютна грешка определяне електронен заряд # 8710; д.
9. Запис резултат на определяне на таксата с границите на абсолютната грешка.
10. Сравнете таксата електрон, определя от резултатите от експеримент, проведен-ТА, с таблични стойност.
