"Tautos" - е една и съща ", Meros" - (. Гръцки) делът на.
Тавтомерия - динамичен феномен на обратими изомери превръщане, срещащи се с разрушаване и образуване на връзки и преместване на атомите придружени (често протон) и групи от атоми по-малко.
Изомерни форми - тавтомери.
За разлика от структурни изомери, тавтомери, като правило, не могат да съществуват отделно един от друг. Независимо от техния прием не е възможно.
Главната особеност е тяхната тавтомерни вещества двусмислен отговор - способността да образуват две серии от производни като резултат от отделен и независим отговор в равновесие две изомерни форми на съединенията.
1. кето-енолна тавтомерия:
2. амиден imidolnaya тавтомеризъм:
3. равновесие пръстен верига tautomeriya- линейни и пръстен (полуацетал форма)
- вид на стереоизомерия, която се определя от разликата в пространственото подреждане на заместителите в молекулите на двойката спрямо равнината на двойната връзка или цикъл.
Поради факта, че молекулите на тези съединения свободното въртене на атома около # 963; -връзките (циклоалкани) и по отношение на я-връзки (алкени) е невъзможно.
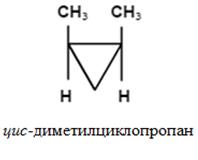
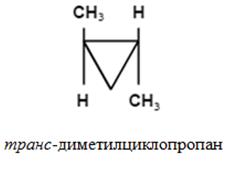
Z, E-номенклатура (за три- и тетразаместени алкени).
Конфигурация изомер се определя от относителното положение на висши заместители. От едната страна на равнината - Z-изомер; на обратната - Е-изомер.
Определянето на предимство се основава на атомния номер на елемента. В случай на еднакви атоми на групите е "втора черупка" атоми:
В случай на групи с различни по старшинство, се увеличава от типа връзка в редиците:
-СН2ОН <-COH Тъй като разстоянието между заместителите в молекулите на различни изомери, последният по същество се различават по техния химически и физически свойства. Те могат да се разделят и да съществуват поотделно. Преходът от един изомер в друг - изомеризация се случва обикновено чрез нагряване или облъчване. - вид на стереоизомерия, която се определя от разликата в пространственото подреждане на заместителите в молекулите, в резултат от свободно въртене около # 963; -връзките. Тези изомери се различават в стабилността. По-стабилни конструкции на които са фиксирани физикохимичните методи се наричат конформатори. Konformer- молекула в конформация, в която неговите атоми спонтанно връщат след малки промени. Изображение конформатори - Нюман проекция: Колкото по-голяма сила на взаимното отблъскване на водородни атоми, по-висока енергия на системата; следователно инхибира конформация ще се срещне минимум потенциалната енергия на молекулата. Като различни конформации, молекули са химически хомогенни; конформационни изомери не са типични. Въпреки това, в някои случаи (в близост пакетиране на молекули), могат да бъдат разделени в различни форми. Конформации Bioorganic молекули (ензими, витамини, протеини, нуклеинови киселини) играят решаваща роля в проявата на биологичната активност на последната. Koformatsii в серия от циклични въглеводороди: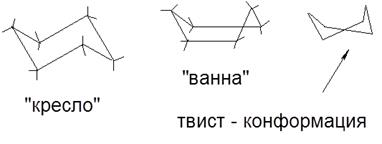
Триизмерни структури на циклични съединения съдържат различни заместители на естеството на състоянието:
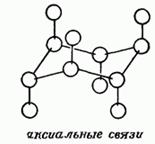
и - аксиален (алтернативно насочени в противоположни посоки от равнината на пръстена)
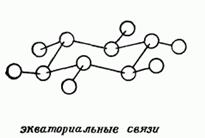
д - екваториална (насочено радиално далеч от равнината и последователно в противоположни посоки)
Някои органични съединения са оптически активни. Те са в състояние да променят равнината на поляризация на светлината, като преминава през материала на пробата (1815 J. Bio).
Light - електромагнитни вълни, вибрации са перпендикулярни на посоката на разпространение. В естествени (слънце) светлината, тези колебания се срещат в различни равнини.
Оптично активните съединения на равнината на поляризация се завърта на определен ъгъл на дясно (дясновъртящ) или наляво (лявовъртящ).
Изомерите се въртят равнината на поляризация в различни посоки, но в същия ъгъл - антиподи (енантиомери).
Рацемичната смес (рацемат) - смес от равни количества от лява и дясновъртящи изомери. Racemate е оптически неактивна.
Оптична активност характеристика на съединения, съдържащи
SP 3 -Hybrid атом (обемен молекула). Ако такъв атом е свързан към четири различни заместители възникне изомерни двойки, в която изомерите са молекулите в тяхното пространствено разположение един спрямо друг, както и на връзката между обекта и огледален образ.
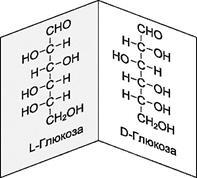
За да се свържете сградата с въртенето, той е бил помолен да изберете връзка стандарт и да ги сравните с други съединения, съдържащи хирален център. Като стандарт, е избран
2,3-dioksipropanal (глицералдехид):
За да се класифицира стереоизомер трябва да определи в него старшинство заместители (пореден номер на елемента - както е в случая на Z, Е-изомер). поглед наблюдател е насочена по заместителят С-ос Jr. (Н). След тази ориентация, изглежда три заместителя са разположени в един ред в посока от най-старите до най-малкият. В sluchaeR-конфигурация, тази процедура съответства на посоката на движение в посока на часовниковата стрелка в sluchaeS конфигурация - обратно на часовниковата стрелка.
Ако молекулата съдържа няколко хирални центрове, броят на изомери увеличава и е равно на 2 п. където п - брой на хирални центрове.
За разлика от структурни изомери енантиомери са идентични един на друг в повечето от неговите свойства. Те се различават само в тяхното взаимодействие с равнината на поляризирана светлина и взаимодействието с вещества, които са също хирален.
В организма реакции възникват с участието на биокатализатори - ензими. Ензимите са конструирани от хирални молекули # 945 аминокиселини. Следователно, те действат като хирални реагенти, които са чувствителни към хиралността на взаимодействие с техните субстрати (стереоспецифичност биохимични процеси). Това води до факта, че хиралните природни съединения са представени като правило, само една стереоизомерна форма (D-въглехидрати, L-аминокиселини).
Стереоспецифичност основата едно проявление на биологичното действие на енантиомери, докато другия изомер може да бъде неактивен, и понякога имат различни или дори противоположни ефекти.
1.3 химичната връзка в органични съединения
В съответствие с квантовата химически представяния въглеродни съединения трябва да двувалентен.
Въпреки това, в повечето им връзки въглероден атом има валентност на IV. Това се дължи на изключване ( "отделяне") с двойка електрони 2s подслой.
Ако химична връзка енергия формация се освобождава, така че появата на две нови възможности за валентност води до освобождаването на допълнителна енергия (1053.4 кДж / мол), която е по-голяма от енергията, изразходвана за пара 2s електрони (401 кДж / мол).
Различни оформени орбитали (S, Р) с образуване на смес връзка, давайки нови еквивалентни хибридизира орбитали (хибридизация теория L.Poling, D.Sleter, 1928-1931.). Концепцията на хибридизация се отнася само до молекули, но не и атомите и орбитална хибридизация влиза само и не електрони върху тях.
За разлика от не-хибридизира s- и р-орбитали хибриден орбитален полярен (електронна плътност е изместен) и е способен да образува силни връзки.
Свързани статии
