
Начало | За нас | обратна връзка
Има два основни вида енергия - кинетичната (причинено от движението на тялото) и потенциал (поради позицията на тялото или части от тях в пространството). Тези два вида енергия се проявяват в различни форми, като например топлинна (топлина), светлина (излъчване на енергия), химически, електрическа енергия, или в други форми.
Според закона за запазване на енергията. Енергийна не е създаден от нищо и не се унищожава и може да се разпространява от един орган на друг и не се преобразуват от една форма в друга. Ето защо, ако по време на процеса на изчезване на енергия от определен тип, изглежда, вместо еквивалентно количество енергия от друг вид. Ние прилагаме идеята за запазване на енергията на химични системи.
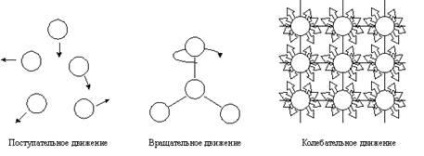
Фиг. 4.1. Видове механично движение.
Атомите, молекули или йони, които съставляват химическата система имат потенциал и кинетичната енергия. Кинетичната енергия от движението на частиците. Това движение може да бъде транслационно, ротационно и вибрационно (Fig.4.1).
Тип кинетична енергия е топлината. то се отнася до движението на атоми и молекули. Потенциалната енергия на частиците е причинена от тяхното взаимодействие една с друга. Например, електроните в атома притежават потенциална енергия по отношение на положителните заряди в ядрото. Свързването енергия - също форма на потенциална енергия. Скъсване и образуване на химични връзки са придружени от промяна в потенциална енергия, тъй като химическите връзки в реакционните продукти и изходни материали могат да се различават съществено.
Сумата на потенциалните и кинетични енергии на всички частици в системата (с изключение на кинетичната и потенциалната енергия на системата като цяло) е система вътрешен енергиен (U). U абсолютна стойност не може да се определи, тъй като е невъзможно да се въвеждат системата в състояние лишено от енергия.
Вътрешната енергия е функция на състоянието на системата, така че неговата промяна (DU) се изчислява по формулата:
Промяната във вътрешната енергия на системата се появява, когато преносната електрическа мрежа или от него. Има два основни начина за предаване на енергия - за трансфер на топлина и изпълнение на работата. Прехвърлянето на енергия, причинени от температурната разлика между системата и околната среда или между една система и друга система, наречена пренос на топлина. Количеството енергия, като по този начин се прехвърля, е обозначен с Q (J) и е равна на:
където m - маса система (кг)
DT - промяна на температурата (К),
С - специфичен топлинен капацитет на материала, от който включва система (J / (кг · K)).
Топлината не е собственост на системата, така че тя не може да бъде функция на състоянието на системата.
Друга форма на пренос на енергия е работа - W (J). Има различни видове работа. В химията, работата е най-често свързани с разширяването на системата. Такова разширение протича с отделяне на газ по време на реакцията. В този случай, извършена от системата работа, се изчислява по формулата:
където Р - външен натиск (Ра), за много химични реакции, външното налягане е атмосферно;
DV = V2 - V1 - промяна на обема система (m 3).
По този начин, промяната на вътрешната енергия (DU) затворената система е равен на разликата на топлина предадена Q система и я прави да работи с, т.е.
Тази връзка се нарича първия закон на термодинамиката. Този закон е един от съставите на закона за запазване на енергията. защото показва, че промяната на вътрешната енергия на системата (DU) е свързан само със системата за пренос на енергия или от него.
4.4.1. Топлинен ефект. енталпия
Обикновено, химичните реакции са придружени от топлинни ефекти. Термично ефект се нарича общо количество енергия, освободена или се абсорбира от реакционната система, провежда при постоянна температура. Точка на химията, която изучава термичните ефекти на химични реакции и фазови превръщания, наречен термохимия.
Съгласно първия закон на термодинамиката (уравнение 4.6) или на броя избран топлина абсорбира Q система определя от уравнението:
Заместване на (4.5) до (4.6), ние получаваме уравнението:
определя топлинен ефект. От уравнение (4.7), че топлината на реакцията зависи от условията, при които тя се появява. В изохорен процес V = конст, DV = 0, следователно, топлината на реакцията е промяна QV вътрешната енергия на системата:
Enthalpy, както и на вътрешната енергия е държавна функция на системата.
За реакции, включващи само твърди вещества и течности, стр · DV план в уравнение (4.10a) е незначително или нула. За такива реакции, DH на връзка »DU. За реакции в газова фаза, които се провеждат с участието на газообразни вещества, обемът се промени значително. Ако DV> 0; има разширение, на DH> DU; ако DV <0, т.е. происходит сжатие, то DH където Dn - промяна на броя на моловете на газ, определен от уравнението на реакцията; например, Химични реакции с освобождаването на топлина се наричат екзотермична. В изохорен процес на вътрешната енергия на системата се намалява, т.е. DU <0 (т.к. U2 Фиг. 4. 2. Промяната в енталпията на системата: а) екзотермична; б) ендотермични реакции. Химичните реакции, проявяващи се с абсорбция на топлина се наричат ендотермични. В изохорен процес DU> 0, в изобарен процес - DH> 0. Намалението на енталпията на екзотермични процеси е, че общата енергия, съдържаща се в реакционните продукти под формата на енергия на химични връзки, междумолекулни взаимодействия, молекулярни вибрации и т.н. по-малко от общата енергия на изходните материали (реагенти). Обратно, увеличаване на енталпията на ендотермични процеси означава, че общата енергия, съдържаща по-голяма от общата енергия на изходните материали в реакционните продукти. Промяната на енталпията в стандартния състояние на веществото. участващи в реакцията или по време на трансформацията на фаза, означен DH ° (Т) и DH ° (298 К) при температура система Т или 298,15 на К. Топлинен ефект зависи не само от условията (температура, налягане, обем), в който те се появяват, но също и от броя на веществата, участващи в реакцията и тяхното физическо състояние. Ето защо, за да може да се сравни ефектите на различни енергийни процеси характеризират ги промените енталпията при стандартни условия, съответстващи на специфична уравнение химическа реакция. Уравнения химични реакции, които са им топлинни ефекти и агрегация състояния (Z-газ, влак течност кристален, трет-твърдо вещество) или алотропна модификация (например, сяра, б-сяра) вещества, наречени термохимични реакционни уравнения , Например: 4.4.2. Термохимична закони. термохимична ИЗЧИСЛЕНИЯ Термалните ефекти на химични реакции могат да се определят експериментално или чрез изчисления. Измерване на топлинни ефекти се нарича калориметрия. В основата на термохимични изчисления е законът формулиран от руския учен, GI Хес (1840):Свързани статии
