Взаимодействието между молекулите. комплексни съединения
В предишната глава беше разгледан взаимодействие атоми да образуват молекули и също показва структурата и свойствата на молекули. Тази глава се фокусира върху взаимодействието на молекулите.
При приближаване молекулното привличане възниква поради Vaeth поява на кондензираната материя. Като бази NYM видове молекулно взаимодействие трябва да включват ван дер Ваалс сили, водородни връзки, донор-акцептор взаимодействие.
През 1873 г. холандската учен Й. ван дер Ваалс предполага, че има сили, които допринасят за привличането между Molek-Лами. Тези сили късно става известен като ван дер Ваалс сили. Те включват три компонента: дипол-дипол, индукция и дисперсионни взаимодействия.
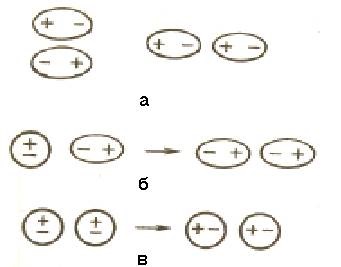
и - дипол-дипол взаимодействието; б - индуциране на взаимодействие;
в - взаимодействие на дисперсията
Фигура 6.1 - ван дер Ваалс взаимодействие между молекули
6.1.1 дипол-дипол взаимодействия ефекти. Когато конвергенция е полярни молекули те ruyutsya-неориентируема така че положителната страна на дипол е ориентирана към отрицателната страна на другата дипол (фигура 6.1, а).
Среща между взаимодействия E-дипол, наречени дипол-дипол или ориентация. Енергията на взаимодействието дипол-дипол е пропорционална на електрически диполен момент на четвъртия силата и обратно пропорционална на разстоянието между центровете на диполи в шестата степен и солна абсолютна температура първа степен.
6.1.2 Индукция взаимодействие. На диполи могат да повлияят неполярни молекули превръщането им в индуцирани (Naveh-dennye) диполи (фигура 6.1, б). Между настъпва постоянни и индуцирани полета ди привличане, чиято енергия е пропорционална на електрически диполен момент на втория силата и обратно пропорционална на разстоянието между центровете на молекулите в шестата степен. индуктивни енергийни взаимодействие нараства с увеличаване на молекулното поляризуемост Rd, т.е. способността на молекулата на дипол-мацията под влиянието на електрическо поле. Поляризуемост стойност, изразена в единици обем. Поляризуемост OD notipnyh молекули нараства с увеличаване на молекулен размер (tablischa 6.1). Енергийна индуктивно взаимодействие значително по-малко енергия дипол-дипол.
6.1.3 Дисперсия атракция. Във всеки молекула, притежаваща колебания електрически плътност, което води до моментално диполи появи, което от своя страна индуцира незабавни диполи на съседни молекули (фигура 6.1). Движение моментните диполи става последователни, разпадането на тяхното появяване и proish-ди синхронно. Взаимодействието на диполи моментната енергия на системата намалява. Енергийно-разпространена взаимодействие Следствие пропорционална на поляризуемост на молекулите, и обратно пропорционална на разстоянието между центровете на частиците. За неполярни молекули диспергира взаимодействие е само компонент на Ваалсови сили на ван дер (Таблица 6.1).
Таблица 6.1 - Принос на отделните компоненти на енергията на молекулните взаимодействия
Напрегнатостта на електрическото поле на момента на дипол, D
Polyarizu- Emost m 3 * 30 октомври
6.1.4 Енергията на ван дер Ваалс взаимодействия. Ван дер Ваалс енергия на всички видове взаимодействие е обратно пропорционална на разстоянието между центровете niju на молекулите в шестата степен.
Ако силно сближаване сила на отблъскване на молекулите са показани-ТА между тях, които са обратно пропорционална на разстоянието между молекулите в дванадесетия степен. Следователно, зависимостта на D-zultiruyuschey ван дер Ваалс енергия взаимодействие EB на раса-разстоянието между молекули, IB. изразена чрез уравнението
където А и В - константи.
Минималната енергия на системата е снабдена с разстоянията между центровете на молекулите 0.4 ÷ 0.5 пМ, т.е. значително по-голяма дължина връзка.
Както се вижда в Таблица 6.1, с увеличаване на размера на обхвата на Аг и Xe-НС1-HI техните поляризуемост увеличава молекулното привличане и енергийния дисперсия-ТА. Ориентировъчна взаимодействие прави значителен принос към-ван дер Ваалс сили само в случай на молекули с голяма електрическа диполен момент. С увеличаване на сумата-Marne енергия на междумолекулна взаимодействието ще се увеличи температурата на кипене на течности и тяхната топлина на изпарение. Общата енергия на ван дер Ваалс взаимодействие между молекули с 1-2 поръчки ниски от енергията на химически връзки.
По този начин, молекулите, които имат относително слаба ван дер Ваалс взаимодействие, включително дисперсия сили и полярни молекули и дипол-дипол привличане и индуциране-нителна взаимодействие.
Свързани статии
