Водят - химичен елемент, разположен в шестата период на периодичната таблица групата IVB DI Менделеев.
Сериен номер - 82. Структурата на един атом е показано на фиг. 1. Metal г-семейство.
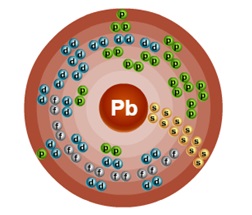
Фиг. 1. Диаграма на водещия атом.
При нормални условия, олово е вещество в твърдо състояние е синьо-бял. От гледна точка на олово повърхност блести. В въздух и покрити с филм от окиси на този затъмнява. Той е много мек и реже с нож. Той има ниска топлопроводимост. Плътност 11.34 гр / см 3 Точка на топене 327,46 ° С кипене 1749 ° С
Моларен тегло олово е 207,2 грама / мол. Тази стойност показва съотношението маса на веществото (т) ти брой молове от дадено вещество (п), означен от М, и може да се изчисли по формулата:
С други думи, моларната маса на веществото, - е теглото на 1 мол на веществото, изразена в г / мол или kkmol.
Водещият може да съществува като газ само под формата на твърди вещества, така че, за да открие стойностите на неговото молекулно тегло не може да се използва стойността на моларен обем, или да се използват изчисления формула Менделеев-Clapeyron.
Примери за решаване на проблеми
Направи уравнение хидролизни реакции водят нитрат (II). Какво ще реакционната среда в решаването на тази сол?
Уравнението на дисоциация на оловен нитрат (II):
Тази сол се образува слаба основа (хидроксид, олово (II) Pb (ОН) 2) и силна киселина (азотна киселина HNO3), следователно протича хидролиза от катиона.
Pb 2+ + HOH ↔ PbOH + + Н +;
PbOH + + HOH ↔ Pb (ОН) 2 ↓ + Н +;
реакционната среда е кисела, както е видно от наличието на водородни йони.
Към разтвор на оловен нитрат (II), тегло 80 гр (масова част на сол, 6.6%) нарасна натриев йодид разтвор шестдесетграм (натриев йодид маса фракция от 5%). Изчислете масата на олово йодид (II), се утаява.
Уравнението взаимодействие оловен нитрат (II) с натриев йодид:
Намираме масата на разтвореното вещество от оловен нитрат (II) и натриев йодид:
ω = msolute / msolution х 100%;
msolute = ω / 100% х msolution;
msolute (NaI) = ω (NaI) / 100% х msolution (натриев йодид);
msolute (натриев йодид) = 5/100 = 60% х 3 гр
Намираме броя молове на вещества непревърнат (моларна маса на оловен нитрат (II) е 331 г / мол, натриев йодид - 150 гр / мол) и се определи кои от тях е в излишък:
п (натриев йодид) = msolute (натриев йодид) / M (натриев йодид);
п (натриев йодид) = 3/150 = 0.02 мол.
Натриев йодид присъства в излишък, следователно всички следващи изчисления чрез провеждане оловен нитрат (II). п (Pb (NO3) 2). п (PbI2) = 1: 1, т.е. п (Pb (NO3) 2) = N (PbI2) = 0016 Mol. След това масата на олово йодид (II), е равен (моларна маса - 461 г / мол):
m (PbI2) = 0016 х 461 = 7.376 гр
Свързани статии
