Структура, свойства, класификация на аминокиселини
При изучаването на състава на протеини е установено, че всички те са изградени на същия принцип и имат четири нива на организация: първични, вторични, третични и някои от тях, както и четвъртична структура на обиколки.
Първичната структура. Той представлява линейна верига от аминокиселини, разположени в определена последователност и свързани заедно чрез пептидни връзки. Peptidnayasvyaz образуван от α-карбоксилната група на един и ви aminokislo-α-амино група на друг.
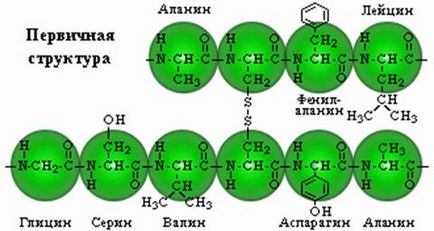
Аминокиселините могат да бъдат комбинирани в дълги вериги Zuy образувани между пептидна връзка. Две аминокиселини образуват дипептид където; ако към него да се добави още един, а след това не е имало-трипептид и т.н. Пептиди, съдържащи до 10 аминокиселинни т наречен олигопептиди, и до 50 -polipeptidami. Зало- lipeptidy, съдържащи повече от 50 аминокиселини, протеини вече посочени, въпреки че това име се използва за съдържащи повече от 100 аминокиселини, повече съединения.
единици аминокиселина, са част от пептид обикновено се нарича аминокиселинни остатъци. Те вече не са аминокиселини, в резултат на образуването на пептидни връзки на всяка от тях липсва един водороден атом в амино група и хидроксилна анион карбоксил. Аминокиселинният остатък, разположен в края на пептида, където има свободен α-амино група, се нарича амино или N - краен остатък; остатъкът в противоположния Con-вд молекулата като свободна карбоксилна група - карбокси терминал или С-терминал. Naz, наличие на пептиди, получени от името на техните съставни аминокиселини съгласно тяхната последователност се излиза от N края.
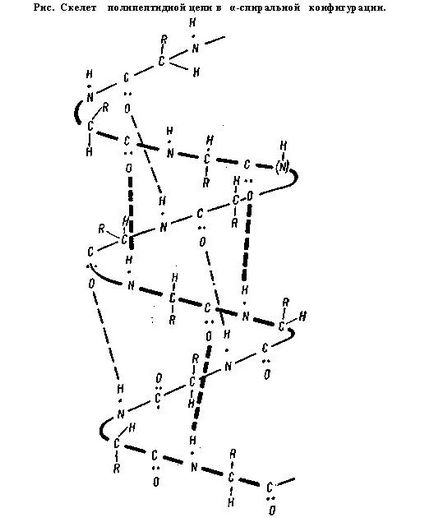
Вторичната структура. Той представлява или - подреден и компактна опаковка на полипептидната верига. Според конфигурация, е във формата на спирала и склад chatoy структура.
В основата на α-спиралата е tidnaya NEN верига и аминокиселинни радикали са насочени навън, се намира на спиралата. Външно, α-спиралата е като леко опъната електрическа намотка. Такава форма е типично за протеини, имащи една полипептидна верига (албумин, глобулин и т.н.).
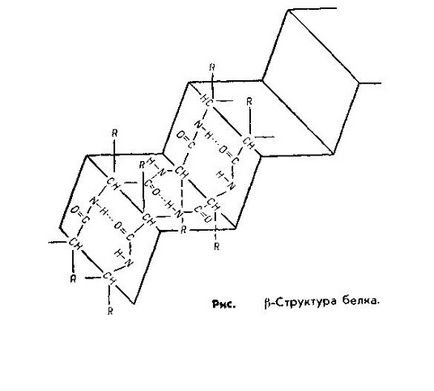
Skladchatayaβ структура представлява SVOCs Kuyu форма и е подобен на козината на хармоника. Това ха особеност за протеини, имащи множество схеми полипептид-ционни подредени паралелно, β-структура намерени в протеини като трипсин, рибонуклеаза, коса кератин, колаген сухожилия.
Образуването на вторичната структура се осигурява от водородна връзка. Тя се формира с участието на водородния атом разположен между два атома silnootritsatelnymi една от които един (в едър) има по-голям афинитет.
Свързаното водород е слаб, че е лесно да Obra-zuetsya и като лесно се разграждат. Молекулата на протеин на този вид комуникация се образува между α-водорода на амино групата на един пептид кислород връзка и β-карбоксилната група на друга.
В α-спиралата образува чрез водородно свързване, така че всяка група NH на пептидната връзка е свързан към четвъртия банката заедно верига CO група, различна комуникация. Тя е тази свързване-НИП осигури спирала верига. Структурата на β-водородна връзка Obra-zuetsya между една и съща група pirovkami-бут-проводящ принадлежността NYM различни полипептидни вериги. По този начин, всички СО- и NH-групите, поли-упражнява пептидни вериги са свързани помежду си чрез водородни връзки бой.
Третичната структура. Като третична структура молекула кръгла протеин е по-компактен пространствено подреждане Noe polipep tidnoy верига, или по-скоро си Auto-матрични структура. Формата на третичната структура може да бъде много различно и се определя от факта, че различните функционални групи на полипептидната верига могат да образуват различни видове връзки (електростатично, йонни, Ван дер Ваалс сила и др ..).
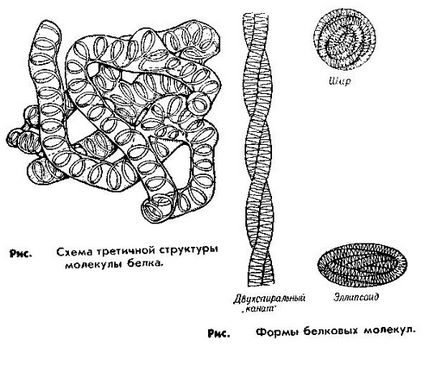
Този тип структура е достатъчно Obus погледа присъствие дисулфид твърд (- С. S-) връзки (дисулфидни мостове), които се образуват между серните атоми на две молекули на цистеин-място с конюгирани към различни места на полипептидната верига.
Тя осигурява третичната структура на протеина и неговите основни функции в зависимост от тази третична структура, или може да бъде представен като болус (глобули) на глобуларни протеини, или и като нишки (фибрили) на фибриларни протеини. Кълбовидните протеини в кръвта и много органи. Техните представители са албумин и глобулини. Фибриларни белтъци, представляват основата на мускулната тъкан.
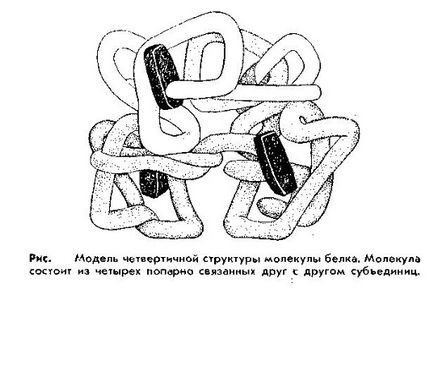
В кватернерна структура. В тялото, има по-сложен в структурата на протеини, съставени от няколко така наречените субединици. всеки от които е молекула, протеин със специфична структура, до третичен. Такова асоцииране на подединици, наречени четвъртична структура. Специално-ност с кватернерна структура на протеини е тяхната способност да упражняват своите функции и свойства само в присъствието на всички субединици. Премахване на най-малко един от тях води до загуба на функция. За една Ким протеини включват хемоглобин, ензими и редица други.
по този начин кватернерна структура разбере структурата на протеини, състоящи се от няколко полипептидни вериги. Всяка една от тези вериги приключи своята триизмерна структура на протеин подгрупа нарича четвъртична структура.
Протеини с високо молекулно тегло золни-купища във вода, способни на набъбване се характеризират с реактивност, мобилност в електрическо поле и някои други свойства. Протеини активно влизат в химични реакции. Това свойство се дължи на факта, че аминокиселините, които изграждат белтъци съдържат различни функционални групи, способни на взаимодействие с други вещества. Важно е, че тези взаимодействия се извършват в рамките на протеиновата молекула, което води до образуването на пептида, водород и други видове дисулфидни връзки. С амино радикали, и следователно протеините могат да се присъединят различните съединения и йони, което позволява транспортиране на кръв.
1. Протеините са високо молекулно свързан niyami. Това полимери, състояща се от стотици или хиляди мономери - аминокиселини. Съответно, молекулното тегло на протеина е в диапазона 10,000 1000000. По този начин, като част от рибонуклеаза (ензим, който разцепва РНК) съдържа 124 аминокиселини и неговото молекулно тегло е около 14000. миоглобин (мускулния протеин), съставен от 153 аминокиселинни остатъци, имащи-на молекулно тегло 17,000 и хемоглобин - 64500 (574 аминокиселинни остатъци). Молекулното тегло на други протеини високи: у _ глобулин (об форми на антитела с) се състои от 1250 аминокиселини и има молекулно тегло от около 150,000 и молекулно тегло над 1,000,000 глутамат дехидрогеназа ензим.
Определянето на молекулното тегло се извършва веднъж или различни методи :. Osmometric, гел филтрация, оптични и т.н. Въпреки това, най-точно е седиментационния метод, предложен от Т. Svedberg. Той се основава на факта, че чрез ултрацентрофугиране с ускорение 900000 гр до скоростта на отлагане на протеини зависи от тяхното молекулно тегло.
2. Най-важно свойство на протеини е техният начин да се покаже-ност като киселинни и основни свойства, т.е. закон. Д. като амфотерни електролити. Това се постига чрез различни дисоцииране групи, включени в радикали на амино киселина.
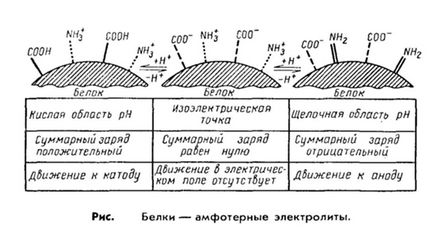
Например, киселинните свойства на протеин свързан карбоксилни групи на аспарагинова и глутаминова аминокиселини и алкална - радикали аргинин, лизин и хистидин. По-дикарбонови аминокиселини, съдържащи се в протеина, по-изразен неговите киселинни свойства и оборота.
Същите тези групи се имат електрически заряди. които образуват общия заряд мол протеин-Кула. В протеини, контролирани аспарагинова и глутаминова аминокиселини, протеин-акция е от отрицателни, излишъкът от основните аминокиселини, свързани с положителния заряд на молекулата на протеин. Вследствие на електрическото поле в протеините ще се движат към катода или анода в зависимост от стойността на общия заряд. По този начин, в алкална среда (рН 7-14) изпраща протон протеин и отрицателно заредена, докато в кисела среда (рН 1-7) се потиска от дисоциацията на киселинните групи и протеинът превръща катион.
По този начин, детерминанта на поведението на протеина като катион или анион, е реакционната среда, която се определя от концентрацията на водородните йони и се експресира от рН. Въпреки това, при определени рН брой положителни и отрицателни заряди е изравнен, и молекулата става електронеутрални. т. е. тя няма да се движат в електрическо поле. Тази стойност на рН се определя като изоелектричната точка на протеини. Когато този протеин е в състояние най-chivom опорна и с малки промени на рН в кисела или алкална страна лесно се утаява. За повечето естествени протеини изо-електрически точка се намира в слабо кисела среда (рН 4.8-5.4). което показва, преобладаването на dikarbopovyh киселини.
амфотерни свойства е основа на буферни свойства на протеини и тяхното участие в регулирането на рН на кръвта. Амфотерните протеини се използват, за да ги разделя на фракции, например чрез електрофореза, за да се диагностицира редица заболявания и контрол на състоянието на пациента, тъй като различни патологични-кал условия фракционна състав на протеини су nificant промени.
3. значение за организма има протеин Способността да адсорбира nekoto ръж вещества и йони (хормони, витамини, желязо, мед и т.н.), които са или слабо разтворими във вода или са токсични (билирубин, свободни мастни киселини) , Протеините се транспортират от кръв към техните сайтове за по-нататъшни реакции или предоставени безвреден-бани.
4. Водни разтвори на протеини имат свои собствени характеристики. Първо, протеини имат висок афинитет към вода, т.е.. Е., Те са хидрофилни. Това означава, че молекула, протеин като заредените частици привличат вода диполи, които са разположени около протеинови молекули, за да се образува водна или хидратация обвивка. Тази обвивка предпазва протеинови молекули от свързване и утаяване.
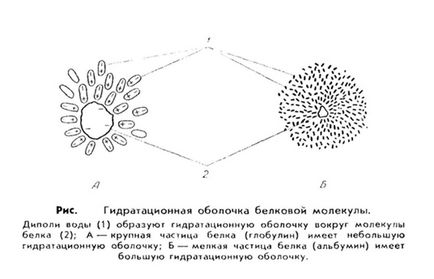
Стойността зависи от хидратация черупката на структурата на протеина. Например, албумини по-лесно да се свързват Xia с водните молекули и имат относително болка Шуй воден черупка, докато глобулини. Fibro-Nogent прикрепен лошо вода и хидрат черупки те имат по-малко.
По този начин, воден стабилността на протеин разтвор се определя от два фактора. по-lichiem електрически заряд на молекулата на протеина и се намира около корпуса на хидратация. Когато изтриете тези фактори протеин утаява. Този процес може да бъде обратим и необратим.
Обратимо утаяване протеин (vysali- vshie) включва утаяване на протеин чрез действието на някои вещества, след отстраняване, където X, той отново се връща в първоначалната си (роден) състояние. Изсолване протеини се използват за алкални и алкалоземни метали (най-често използвани в практиката на натриев сулфат и амониев). Тези соли се отстраняват чрез водна риза (причина дехидратация) и премахване на заряда. Между количеството на хидратация обвивка на протеинови молекули и концентрирана atsiey соли съществува пряка връзка: по-малка обвивка хидрат, е необходимо по-малко сол. Така глобулини като тежки и големи и малки молекули утайка хидратация обвивка от непълна разтвор насищане соли и албумини като малки молекули, заобиколени от голям вода обвивка, - при пълно насищане.
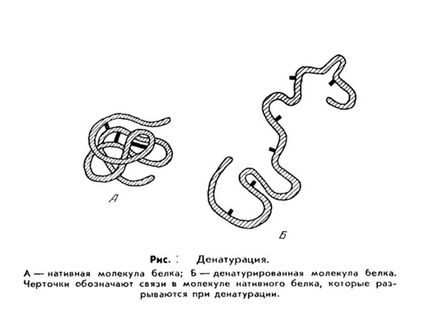
Необратими отлагане свързан с дълбоки промени в вътрешномолекулна структура на протеина, което води до загуба на естествените си свойства (разтворимост, биологична активност и т.н.). Този протеин се нарича денатуриран. и процеса - денатуриране.
Денатуриране на протеините (от латински де- - префикс което означава разделяне, преместване и лат природа - природата; .. не се бърка с броня denaturatus - лишени от естествените свойства.) - Терминът Biological Chemistry, загуба на протеини на физическите свойства (разтворимост, хидрофилност, и т.н. означава .) в резултат на нарушаване на пространствената структура на молекулите.
Процесът на денатуриращи отделни протеинови молекули, което води до разпадането на своята "твърда" триизмерна структура, понякога се нарича слята молекула.
Почти всеки забележима промяна във външните условия, например загряване или киселинна обработка на протеина води до нарушаване на серийния кватернерни, третичен и вторични протеинови структури. Обикновено денатурация причинена от увеличаване на температурата, чрез действието на силни киселини и основи, тежки метали, определени разтворители (алкохол), радиация и др.
Денатурация често води до факта, че колоиден разтвор на протеинови молекули възниква протеинови частици агрегират в голям процес. Визуално изглежда, например, формирането на "протеин" при пържене яйца.
Денатуриране на протеините се извършва в стомаха, където има силно кисела (рН 0.5 - 1.5), и насърчава разцепване от протеолитични ензими, протеини.
Денатуриране на протеини като основа за лечение на отравяния tyazhe-lymi метали, когато на пациента се прилага перорално п-опорно или сурови яйца, за да метали, денатурация-riruya млечни протеини и яйца, адсорбирани на повърхността си, и няма ефект върху стомашната лигавица протеини и на червата, както и не-издърпващи Валис в кръвта.
Ренатуриране (изсолване) - обратния процес на денатуриране при което протеини възвърне тяхната естествена структура. Трябва да се отбележи, че не всички протеини са в състояние да ренатурират; по-голямата част от разграждането на протеина е необратим.