лесно свързване
Най-простият органично съединение - метан. молекула му се състои от пет атома - един въглероден атом и четири водородни атома са равномерно разпределени в пространството около централния въглероден атом. Тук са изправени предимно с основните принципи на органичната химия - всички незаредени органични молекули въглероден винаги е четиривалентен. Графично, това е отразено във факта, че той трябва да бъде свързан с химически символи или други елементи на същите четири въглеродни тирета. Метанът всички четири водородни атоми са на еднакво разстояние от въглероден атом и максимално разстояние един от друг в пространството.
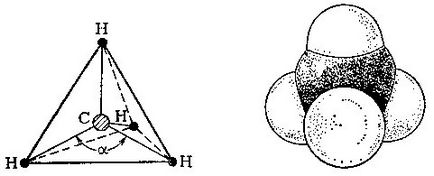
В молекула на метан въглероден атом е в центъра на редовен тетраедър и четири водородни атоми - в своите върхове.
Изглежда метан молекула с размера на атома.
За изграждане на модел на молекулата, да тетраедър, т. Е. Правилното тетраедър състои от равностранен триъгълник и се поставя в центъра на въглероден атом. Водородните атоми ще бъдат разположени във върховете на тетраедъра. Свързване всички водороди на централния въглероден атом. ъгъл # 945; между две такива линии ще бъдат 109 градуса и 28 минути.
Така че, ние построен модел на метан. Но това, което са големината на молекулата в действителност? През последните десетилетия, с помощта на физични методи на изследване (около тях по-нататък) е възможно да се определи точно interatomic разстояния в молекули на органични съединения. В молекула на метан разстояние между центровете на въглероден атом и всеки водороден атом е 0.109 пМ (1 нанометър, пт = 10 -9 m). За да се визуализира как изглежда молекула в пространството, да се насладят на моделите Стюарт - Brigleba, в които атомите са представени от топки от радиус.
Сега ние ще поиска този въпрос: какво сили свързват атома в молекулата на органично съединение защо водородните атоми не са отделени от центъра на въглерод?
въглероден атом се състои от положително заредени ядро (заряда равна 6) и шест електрони, заемащи различни * орбити около ядрото, всеки от които съответства на определено ниво на енергия.
* (Orbital може да се разглежда като част от пространството, в което е вероятно да отговарят на най-електрон)
Две електрони заемат най-ниската най-близо до ядрото орбитална. Всички те си взаимодействат по-силно с "тяхната" ядро и да участват в образуването на химични връзки не приемат. Други бизнес - Останалите четири електрони. Имайте предвид, че така наречената спокоен глас въглеродния атом, т.е., в отделен атом, не се образуват никакви връзки с други атоми, тези електрони са разположени както следва: .., две в долната подслой и две те при по-висока подслой стр. Малко по-опростена и схематично можем да предположим, че облак, който образува електрона в S -podurovne, има сферична форма. Облаци п електрони изглежда обемисти осмици, тези осем могат да бъдат подредени в пространството по осите X, Y и Z. Съответно, във всеки атом има три р орбитали: пиксела. Ру и ЗЗ. По този начин, всеки орбитален в един атом е определена форма и е разположен по специален начин в пространството.
За да се ангажират с други атоми, за да се образува химически връзки с тях, въглероден атом, трябва първо да се по-специално, възбудено състояние. В този единствен електрон орбитални хмел от и към р орбитала. В резултат на един електрон заема сферична и орбитален и останалите три електрони образуват три осмици орбитите на. Въпреки това, тази ситуация атом е енергично неблагоприятна. По-ниска енергия атомна орбитала съответстват на четири идентични, симетрично разположени в пространството. Ето защо, има смесване, хомогенизиране, или, както се казва, хибридизация на орбитали на разположение. и в резултат се получават четири нови идентични орбити.
Тези хибридни орбитали също са подобни на осем, но осем десценденс: електронната плътност е почти напълно изместен към едната страна. Такива SP хибридизираните орбитали са определени три (броят на електрони с различни не-хибридни орбитали, участващи в образуването им: един и орбитален и три - с р орбитали).
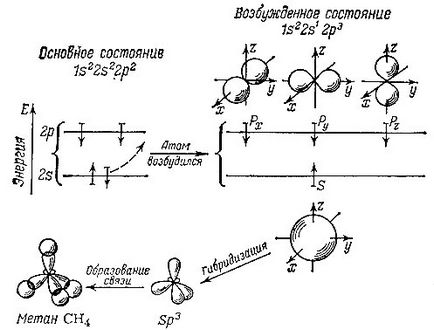
Там е показано схематично орбитална хибридизация в образуването на молекулата на метан. Стрелките показват относителната посока на електронните спинове
Като молекула метан разположени? Всяка от четирите хибридни орбитали въглеродни атоми, насочени в различни посоки (или по-скоро в ъглите на въображаема тетраедър, които могат да бъдат конструирани около него), годни водороди N. атом vodoroda- това ядро с зареждане на 1 (за обикновена светлина изотоп на водорода - протон), и един електрон заема сферична орбитално около протона. Облаци "въглеродни" и "водород" електрони се припокриват, а това означава образуването на химически връзки. Колкото по-голямо припокриване на електрони облаци различни атоми, по-силен е връзка. Сега става ясно защо хибридизираните орбитите печеливши - защото такъв едностранчив, изпъкнали от едната страна и осем може много повече се припокриват с електронен облак на водорода, с по-малък обхват в космоса не е хибридни орбитали. Имайте предвид, че тези аргументи са в известна степен произволни: чиста, така да се каже, един-единствен и спокоен глас въглероден атом не съществува наистина. Поради това, че няма смисъл да се обсъди как да се случи в действителност всички тези трансформации на орбитали, наречен хибридизация. Въпреки това, за удобство на описанието на химически връзки чрез формули и номера, тези конвенции са полезни. Ние сме в този все още не отново да се уверите.
Как да стигнем метана?
Един от най-простите начини - ефект на водата на алуминиев карбид:
Въпреки това, алуминиев карбид - скъпия изходен материал за такива продукти конвенционални, евтини като метан, и получаване от не са необходими други съединения - за природен газ се състои от 85-98% метан.
Метан - един от основните "изграждащи блокове", което конструират органични съединения. Какви са тези съединения, и как да ги измъкне от метана?
В действителност, метан - веществото е относително инертен, и набор от химични реакции, които могат да се направи, е малък с него.
Вземете смес от два газове - метан и хлор и се поставя в стъклен буркан. Ако този кораб е бил държан в неведение, не се наблюдава реакция. Но ние ще се опитаме да се подчертае бутилка слънчевата светлина.
Quant светлина взаимодейства с хлор молекула, в резултат молекула се разделя на две части - два хлорни атома:
Получените атоми са много по-активни молекули, те веднага атакува молекулите метан и улавяне водородни атоми. В тази форма хлороводород HCl молекули са много нестабилни и много реактивни видове, така наречените метилови радикали # 8901; СН3.
Метилов радикал нататък "разделя" молекула хлор:
Резултатът е вече известен хлорен атом (лесно да се предскаже бъдеще съдба: той атакува нови метан молекули и всички повторения) и хлорометан, метилен хлорид, или - метан производно, където един от водородните атоми, заместени с хлор.
Реакцията, която ни казаха, принадлежи към категорията на така наречените верижни реакции. в която всеки етап, както в, свързани с предходната и последващо верига. Активните частици - продукта от стъпка (тук, хлорни атоми и метилови радикали # 8901; СН3) използувана в следващия етап като изходни материали. Откриването на верижната реакция е един от най-големите събития в историята на химията, и академик NN Семьонов и английски учен SN Hiishelvud за неговия принос към изучаването на такива реакции и създаването на техните теории са удостоени с Нобелова награда.
Ако реакцията е да се въведат такива количества реагенти за един хлор молекула има две молекули на метан, като цяло, се получава метил хлорид СН3 Cl. Ако вземем хлора в излишък, реакцията на заместване ще допълнително и ще, в допълнение към метил хлорид, метиленхлорид още СН2 Cl2. хлороформ CHCI 3, и най-накрая, продуктът на пълно заместване на водород в продължение на хлор, тетрахлорметан CCl4.
Но нека не забравяме, нашата задача: да се изгради най-различни сложни молекули от прости градивни елементи на метанови молекули. За това ние трябва метилов хлорид. Ако ефектът на това съединение с метален натрий, след това на всеки две молекули СН3 Cl етан образува една молекула, в която има въглерод - въглерод:
Какво е етан? Това метан, в която един от водородите заменя с метилов радикал # 8901; СН3. И този радикал, както вече знаем, се получава отделяне на метан от водороден атом.
Ако сега в етан да замени един от водородните (всеки атом) до метил, тогава се ново вещество - Пропан СН3-СН2-СН3. Как това може да се направи на практика, ние знаем: първо, в метан и етан замени един водороден хлор, и след това да действа на смес от метил и етил хлорид, натриев (тази реакция се нарича реакцията Wurtz след френски химик, който го открил):
Хайде. Пропан вместо в един от водородните атоми на хлор. Оказва се, че не всичко е сега равен, която да замести един атом! Смяна на водород при крайния въглероден атом (две такива атома), или в среда, ние получаваме две различни съединения: нормален пропил (п пропилхлорид) и изопропил хлорид:
Сега замени всяко от тези съединения, за хлорни атоми на метиловите групи. Ние се две различни бутан - нормална (т.е. не разклонена ..) бутан (п -бутан) и изо-бутан:
Разпоредителите в молекулата си повече от "градивните елементи". Да започнем с п-бутан. Там може да бъде заместен при един от крайни метилови водородни атоми. Ние се получи нормален пентан. Можете да замените един от вторични водорода. Ние идваме при всеки -pentanu. Очевидно е, че от п бутан нищо ново да се получат. Нека се обърнем към всеки -butanu. Ако на мястото на един от водородите екстремни (в СН3 -групи), стигаме до вече споменатите изо -pentanu, и заместване на средната единичен водороден атом, неопентан получаване на:
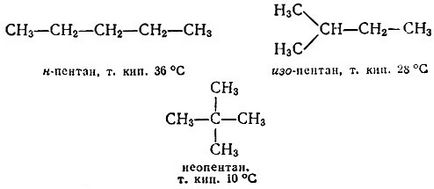
Продължете този процес е безкраен. Всички тези съединения се наричат въглеводороди (по-точно - гранични, наситени въглеводороди или алкани), тъй като те се състоят само от два елемента, въглерод и водород. Във всеки алкан брой водородни атоми е 2п + 2, където п - брой на въглеродни атоми. Поради това ограничение формула на въглеводород обикновено могат да бъдат написани като: С п + 2 H2N.
При изграждането на структурите ни, ние трябва да кажем, навреме, за да спре. Фактът, че броят на възможните изомери увеличава бързо драстично с увеличаване на броя на въглеродните атоми в молекулата алкан. Така че, за Дийн, въглеводород C10 H22. 75 различни възможни изомери, броят на въглеводородни изомери до С20 Н42 (ейкозан) е равна на 366 319. Броят на възможните изомери за tetrakontana, въглеводород C40 H82. че е трудно да си представим, 62 491 178 805 831.
Сега става ясно защо днес ние знаем, голям брой органични съединения - няколко милиона - и защо, в това отношение, химия, органична химия, неорганична далеч напред. Но все още само се говори за най-простите представители на органична материя - от наситени въглеводороди.
Ние заключи брой изомерни въглеводороди от метан с помощта на реакцията Wurtz. Въпреки това, на практика, защото никой не идва. Фактът, че най-простият въглеводород, заедно с метан, съдържаща се в природен газ, съставът на която варира за различни области. Например, в газови находища Северна Ставропол, съдържаща 85% метан, етан около 5%, 2.5% пропан и 1,4% от пентан и по-тежки въглеводороди. област газ Gazlinskogo се състои от 98% метан, етан него само 1,6%. Много от въглеводороди в масло, но повече за това - в следващите глави.
Нисши въглеводороди - метан, етан, пропан и бутан - безцветен, без мирис газове или слаба миризма бензин. Въглеводороди от пентан да пентадекан С15 Н32 - течност и накрая, висши въглеводороди при стайна температура - твърди вещества.
Някои примери за използването на метан
Тъй като броят на въглеродните атоми се увеличава температурата на кипене и топене на съединението.
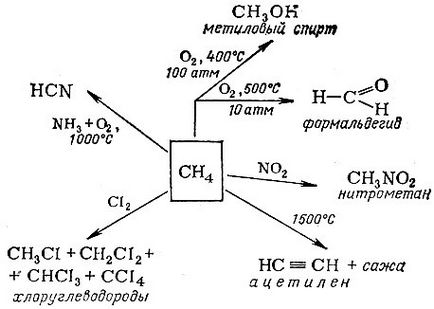
В наситени въглеводороди имат различно име - парафини. отразяване на техните химическа инертност (латински parum affinis - нисък афинитет). И все пак те са широко използвани в химическата промишленост за производство на различни вещества. Основната промишлената употреба на посоката на метан е показано на диаграмата.
Преди да завърша говорим за метан и наситени въглеводороди, за да отговори на един въпрос: Как е връзката на парафини между два въглеродни атома, например, в етан? Това е проста - около всеки въглероден атом е предвидено, както в метан, четири SP 3 хибридизират орбитали, три от тях комуникира с водородни атоми, и един припокрива точно със същия орбитален друг въглероден атом. Дължината на връзка С-С е 0.154 пМ.
