Досега говорихме за натиска на една газова - кислород, водород, и т.н., но в същността и технологията, ние често трябва да се справят със смес от няколко газове ... Най-важният пример за това - на въздух, смес от азот, кислород, аргон, въглероден диоксид и други газове.
Газова смес се разбира смес от отделните газове, влизащи един от друг във всяка химична реакция. Всяка газ (компонент) в сместа, независимо от други газове напълно запазва всички свойства и се държи като че ли е един изпълва целия обем на сместа.
Какво определя налягането на газа?
Поставете в колба парче вещество-ва химично свързване кисел вид на въздух (например, фосфор) и бързо се затваря колбата запушалка с тръби кортеж. свързан с живак манометър. След известно време, всички кислород въздух обедини с фосфор. Ние ще видим, че габарит показва по-малко налягане, отколкото преди отстраняването на кислород. Следователно, присъствието на кислород във въздуха увеличава налягане.
Точната смес изследвания налягане газ първо се произвежда от британски химик Джон Далтон през 1809 г.
Определете (1803) закон за кратните отношения, въвежда понятието "атомно тегло", първо да се определи атомното тегло (маса) на редица елементи. Отварям законите на газ, които носят неговото име.
Смята се, че първата точно описание на далтонизъм даде през 1794 г., на английски химик Далтън, за да бъдем точни - Dalton (Джон Далтон). Ето защо, аномалиите за данни е дадено името "далтонизъм".
Англичанинът Джон Далтон, въпреки отхвърлянето му, той е живял 78 години.
Той имал трима братя и една сестра, двама братя също пострадаха tsvetoslepotoy на червено.
По това време не знаехме нищо за гените и законите, които управляват наследство, но Далтън е описано подробно семейството му дефект, както и неговото възприемане на света. Благодарение на описанието на неговия дефект, името му е вече 200 години е известно, че всеки ученик.
Историята ни учи много пъти, че всички гениални хора възприемат света около тях, както и естеството на явлението не е така, като всички останали. Това е, за да ги дължим на новите открития и изобретения.
Tsvetoslepye един цвят и хората с намалена цветоусещане възприемат цветовете на света около тях по различен начин, но често не забелязват различията си от другите. Понякога не го забелязват и околностите. Така че, Далтън, което не се прави разлика между червено, не знаех за цвета му слепота до 26 години.
В опит да се разбере защо газовете в атмосферата представляват смес на някои физични свойства, но не са разположени един под друг слоеве в зависимост от тяхната плътност, се установи, че поведението на газа не зависи от състава на сместа; формулирани закона на частичните налягания на газове, открит зависимост от разтворимостта на газове от тяхното частично налягане.
Налягането, което ще има всяка от газове, съставляващи сместа, ако се отстранят останалите газове от обема заета от сместа се нарича парциално налягане на този газ. Dalton установено, че налягането на газовата смес е сумата от парциалните налягания на неговите компоненти (право Далтон).
право състояния налягане на сместа Dalton е равна на сумата от парциалните налягания на газовете, образуващи сместа. , Той призова парциалното налягане.
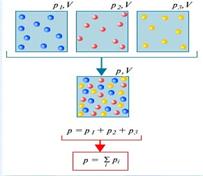
Разглеждане на газ, състоящ се от молекули на различни вещества, които са в обем V. Поради случаен топлинна движение на молекулата на всеки компонент на сместа се разпределя равномерно по целия обем, т.е. като че ли на другите компоненти на газа не са били на разположение. Поради постоянни молекулни сблъсъци помежду си, придружени от частичен обмен между импулси и енергии, термично равновесие е установен в сместа. Всичко това води до факта, че налягането на всеки компонент на сместа не зависи от присъствието на другите.
След това, полученият налягане се определя от общото налягане на всички компоненти.
Имайте предвид, че правото на силно сгъстени газове Далтон не е приложима, както и правото на Бойл - Mariotte.
Първият закон на термодинамиката (PNT)
Да предположим, че една термодинамична система (например, газ, съдържащ се в цилиндър под буталото) като вътрешен енергиен U1, получен определено количество топлина Q и като отворите ново състояние, характеризиращо се с U2 вътрешната енергия, за извършване на работа на външната среда, т.е. , срещу външни сили. В този случай Q = U2-U1 + А или
Уравнение (4) изразява POT: топлина се предава на системата, тя се изразходва за промяната в своята вътрешна енергия и да я накара да работи срещу външни сили.
За безкрайно експресия процеси (4) се записва под формата на диференциално DQ = Du + Da или повече правилна форма
тъй като само общо диференциално Du и г Q г и общо разлики не са.
От (5) следва, че количеството топлина в SI се изразява в същите единици, и че работната енергия, т.е. в джаула (J).
Ако системата периодично се връща в първоначалното си състояние, промяната в неговата вътрешна енергия D U = 0. След това, съгласно (4), т.е., А = Р. вечен двигател от първи вид, което щеше да направи много работа за него, отколкото отчетения външно захранване не е налична. Това е една от формите, съгласно първия закон на термодинамиката.
Свързани статии
