Лабораторни методи за получаване на субстрати.
Библиотека / Причини / библиотека / Причини / лабораторни методи за получаване на субстрати. Лабораторни методи за получаване на субстрати.
При лабораторни условия, основата е изготвен в малки количества, не повече от сто - двеста грама. Понякога повече, в зависимост от специфичните нужди на лаборатории в материала. Но тези суми са малки. В големи количества основа в химико-технологична лаборатория може да произвежда само в случаите, когато изпълняват метод на подготовка на този материал за промишлеността.
Разглеждане на основните методи за получаване хидроксид в лабораторията.
В лабораторията за получаване на хидроксиди на алкални метали се използват два начина. Първата и най-скъпите, е пряка реакция на алкални метали с вода, при което получените алкалите. Този метод може да се използва NaOH, КОН, LiOH, Са (ОН) 2.
Тези реакции са много опасни поради използването на активни метали: натрий, калий, литий. Не могат да бъдат използвани в тези реакции, големи количества алкални метали, те могат да се възпламеняват и дори взривят.
В лабораторни условия са приложени и опростени методи за промишлено производство на натриев хидроксид. Защо натриев хидроксид. тъй като това е най-широко използвани от всички хидроксидите в областта на химията и промишлеността. За да се получи използвайки метод за електролиза. Схема електролиза поток единица се индуцира в Фигура 2.
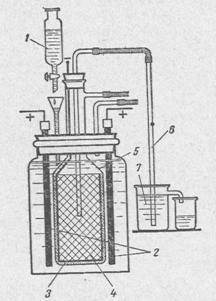
2 - аноди от графиката-ТА;
3 - диафрагма на азбест борда;
4 - катода във формата на цилиндър с дъното на желязна или стоманена мрежа;
5 - стъклена камбана;
6 - на сифон за изместване на разтвора катодната камера;
7 - чаша за получаване на алкален.
Краищата на анодите графитните стърчащи над разтвора трябва да бъде предварително импрегниран с разтопен парафин, електролита не се повишава през капилярите и не унищожават контакт с мед. Контакт меден проводник с графитен анод се извършва с мед капачка плътно облечени към анода, или здраво намотка меден проводник на дестилира края на електрода. Катодът е стомана или стоманена мрежа. Тя трябва да бъде най-добре своето удобно плътно в стъклен звънец, така че водород не влиза анодното отделение. Азбест, предварително навлажнен с вода, с добавка на много малки количества от силикат лепило се прилага като суспензия към външната страна на желязо на окото (дебелина 5-10 тМ). След азбестът е суха, тя може да бъде малко по-запалване, за да остане силна диафрагма и електролит. изисква скорост на захранване и електролит преливника се постига с помощта на делителна фуния с кранче, както е показано на фигура 1.
Хлор и водород може да се използва за производството на синтетичен солна киселина. За тази цел те се подават в горелката, която е чаша чай напълнена със силикагел.
Изтичащият поток от електролитния разтвор се изпарява в порцеланова чиния. От време на време се слива с утайка сол течност част, на края на изпаряването температурата се довежда до 500 ° С След това алкално топене се охлажда, раздробява и се съхранява в затворен стъклен съд. Абсолютно чист алкален се получава чрез охлаждане на тридесет и пет процента разтвор на натриев хидроксид до техническата 5 ° С. Кристалите попадат NaOH х 2H2O и NaOH х 4H2O, която се отделя от разтвора и се калцинира.
По същия настройка могат да бъдат получени и калиев хидроксид и литиев хидроксид. При получаване на основи на тази инсталация трябва да се вземат специални мерки за повишено внимание, тъй като един от продуктите на електролиза е хлор.
За натриев хидроксид се използва понякога дори по-стар метод - кипяща сода разтвор с хидратна вар:
След като реакционният разтвор се декантира от утайката от калциев карбонат и се изпарява водата, полученият слят натриев хидроксид.
Много често, за извършване на химични реакции в лаборатории трябва да се получи неразтворими хидроксиди като хидроксиди на мед, цинк, кобалт, кадмий, никел. За тяхното получаване, използване на реакцията на разтворими соли на тези метали с натриев хидроксид. Поради естеството на взаимодействието на този отговор се отнася до реакциите обмен.
Меден хидроксид (синьо) и никел хидроксид (зелено - синьо) ще падне в утайката. След филтруване на разтвора и промиване на утайката, тя може да се използва в химически процеси. Така получените хидроксиди на мед (II), цинк, кобалт, кадмий, живак (II), калай, олово, манган, титан, хром, както и много други метали.
Вижте също
Polymeranalogous конверсия на стирен-бутадиен каучук
При реакцията на полимера разбират всички химически трансформации на макромолекули, образувани по-рано. Тези реакции могат да протичат при запазване, увеличаване или намаляване на степента на полимеризация.
Съвременни тенденции и новите тенденции в полимерната наука
Съвременни тенденции и новите тенденции в полимерната наука ясно илюстрирани чрез изследване, проведено от Руската фондация за фундаментални изследвания (RFBR) В момента инча
Свързани статии
