1. Понятието химични реакции
2. Класификация на химични реакции по различни причини
Списък на използваната литература
Вещества, взаимодействащи помежду си, са обект на различни промени и трансформации. Например, берилий, взаимодействащ с атмосферен кислород при температури над 500 ° С се превръща в берилиев оксид; изгаряне на въглища, за да се образува въглероден диоксид и т.н.
Явления, в които някои вещества се превръщат в други различни от оригиналния състав и свойства, и по този начин не променя състава на атомните ядра, наречен химически.
Окисляването на въздуха, горене, производство на метали от руди, ръждясване на желязо - всички химични явления. В противен случай, те се наричат химични трансформации, химически реакции и химическите взаимодействия.
Целта на тази дейност е да се изследва характеристиките на химичните реакции и тяхната класификация.
Работата се състои от въведение, две глави, заключение и библиография. Общата сума на работа 17 страници.
1. Понятието химични реакции
Химичните свойства на вещества са посочени в различни химични реакции. трансформация на вещества, придружен от промяна на техния състав и (или) структура и се наричат химични реакции.
Това често се случва, и такова определяне: химическата реакция е процес на трансформация на изходните материали (реактанти) в крайното съединение (продукти).
Reagenty- средство влиза в химична реакция.
Продукти- вещества, получени чрез химическа реакция.
Реагенти → Продукти
Преведено от латински "реакция" означава ", устойчивост, отговор." Следователно, химическата реакция термин може да се разбира като действие отговор на вещество при излагане на външни вещества и други физически фактори - топлина, налягане, радиация. Но под това определение попадат и физични процеси: точка на топене, кипене, замразяване и др. Поради това трябва да се изясни, че химическата реакция - това е промяната на видовете, в които прекъснатата старата и образуването на нови химични връзки между частици (атоми, йони), от които са изградени от значение.
"Движеща сила" реакция зависи не само от естеството на реагентите и получените съединения (състава си структура), но също така и от концентрацията на вещества, температура, налягане, ефект разтворител, съединения могат да образуват комплекси с реагентите и продуктите.
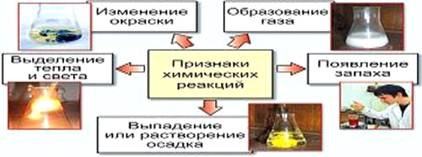
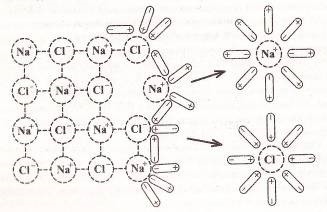
Химични реакции винаги са придружени от физични въздействия - абсорбцията или освобождаване на топлина, промени в агрегатно състояние и оцветяващи средства; от наличието на тези ефекти често се оценяват по реакцията (Фигура 1).
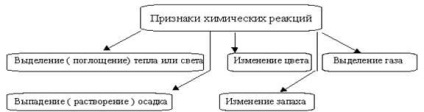
Фигура 1 - Симптомите на химични реакции
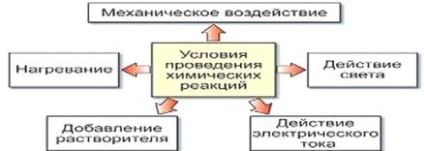
Химични реакции трябва да бъдат разграничени от физически процеси, които променят само външната форма или състоянието на материята (но не и състава). е настъпило условията, които трябва да бъдат изпълнени, за да химическа реакция:
1. Необходимо е, че реагентите влизат в контакт, и колкото по-голяма площ на контакт, химическата реакция ще настъпи по-бързо.
2. Някои реакции протичат без нагряване, е необходимо за някои от реакциите.
3. Някои реакции протичат под въздействието на електрически ток и светлина
Химични реакции са записани с помощта на химически уравнения. Формула съдържащ изходни материали и реакционните продукти, например:
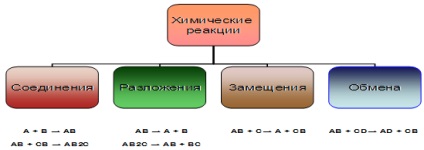
A + B = AB едно съединение, формирано от няколко прости или сложни вещества
AB = A + B От комплекс веществото, произведено няколко прости или сложни вещества
A + BC = AC + B атом прост вещество замества един от атомите на комплекс
AB + CD = АД + ЦБ сложни вещества обменят техните съставни части
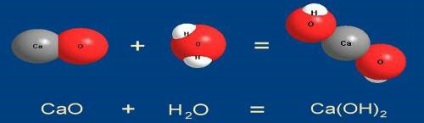
1. Реакциите на съединения. Менделеев определено съединение като реакция ", в която две вещества се появява един. По този начин, когато съединение от няколко реакции на реагентите относително прост състав получава едно вещество, по-сложен състав,
Чрез взаимодействие на съединение с горивни процеси включват прости вещества (сяра, фосфор, въглерод) във въздуха. Например, изгаряния въглеродни във въздуха C + O2 = CO2 (разбира тази реакция се извършва постепенно, първо се образува въглероден монооксид CO). Обикновено тези реакции са придружени от топлинна енергия, т.е. доведе до образуването на по-стабилни и по-малко богати на енергия съединения - са екзотермична.
Взаимодействие на съединение прости вещества винаги са редокс характер. съединение реакции между сложни вещества могат да възникнат както непроменен валентност
СаСО3 + СО2 + H2O = Са (HCO3) 2
и да бъде сред най-окислително-редукционни
2FeSl2 + Cl 2 = 2FeSl3.
2. Реакциите на разлагане. Химическите реакции на разлагане, съгласно Менделеев "случаите, обратна връзка, т.е. тези, при които едно вещество, осигурява два или по принцип определен брой вещества - повече от тях.
реакции на разлагане водят до образуването на един повече съединения от комплекс вещество
Продуктите на разграждане на съединение могат да бъдат както прости и сложни вещества. Един пример на реакцията на разлагане може да служи като реакция на химичното разлагане на креда (варовик или при температура): СаСО3 = СаО + СО2. За провеждане на реакцията на разлагане обикновено изисква загряване. Такива процеси - ендотермичен, т.е. продължи с абсорбцията на топлина. От реакциите на разпадане, които се случват без промяна валентни състояния, трябва да се отбележи разпадане кристални, основи, киселини и кисели соли на кислород
CuSO4 5H2O = CuSO4 + 5H2O,
Cu (OH) 2 = CuO + Н 2О,
H2SiO3 = SiO2 + H2O.
Чрез реакции на разграждане на характера на редокси отнася разпадане оксиди, киселини и соли, образувани с елементи в най-високата окислението
4HNO3 = 2H2O + 4NO2O + O2O,
2AgNO3 = 2ag + 2NO2 + O2,
(NH4) 2Cr2O7 = Cr2O3 + N2 + 4H2O.
Особено характерно реакция редокси разлагане до соли азотна киселина.
реакции на разпадане в органичната химия, за разлика от реакцията на разлагане на неорганична химия, имат специфичност. Те могат да се разглеждат като обратния процес на присъединяване, както се формират или цикли в резултат на често сложни връзки.
Реакцията на разлагане в органичната химия се наричат крекинг
= + S18H38 S9H18 S9H20
или дехидрогениране C4H10 = C4H6 + 2Н2.
В реакциите на другите два вида броя на реагенти, равен на броя на продукти.
3. заместващите реакции. Тяхната отличителна черта - просто вещество взаимодействие с комплекса. Такива реакции са в органичната химия. Обаче, терминът "заместване" на органична материя е по-широка, отколкото в неорганична химия. Ако молекулата на изходното вещество на всеки атом или функционална група са заменени с друг атом или група, тази реакция заместване, също, въпреки че от гледна точка на неорганична химия процес изглежда обмен реакция.
Когато реакцията на заместване обикновено е прост вещество взаимодейства с комплекс образуващ агент и други прости по-сложно, A + BC = AB + C.
Например, понижаване на стомана пирон в разтвор на меден сулфат получи железен сулфат (желязо меден изместен от нейната сол) Fe + CuSO4 = FeSO4 + Cu.
Тези реакции поразително принадлежат на редокс
2AL + Fe2O3 = 2Fe + Al2O3,
Zn + 2HCl + Н2 = ZnSl2,
2KVr + Cl2 + Br2 = 2KSl,
2KSlO3 + L2 = 2KlO3 + Cl2.
Примери на реакции на заместване, които не са придружени от промяна в валентни състояния на атомите е изключително редки.
Трябва да се отбележи силика реакция с кислородни киселини соли, които съответстват газообразни или летливи анхидриди
СаСО3 + SiO2 = SaSiO3 + CO2
Са3 (РО4) 2 + ZSiO2 = ZSaSiO3 + Р2О5.
Понякога тези реакции, считани за реакция на обмен
CH4 + Cl 2 + HCl = SN3Sl.
4. обменни реакции (включително неутрализация). обменни реакции наречени реакция между две съединения, които се разменят между техните съставни
Голям брой от тях се провежда във водни разтвори. Пример за реакция на химически обмен е неутрализирането на киселината с алкален
Тук реагентите (вещества оставя да престои) водороден йон от съединение HCl обменя с натриеви йони от съединението NaOH, с разтвор на сол във вода.
Ако реакции на заместване протичат редокс процеси, реакцията обмен винаги се случи без промяна на валентности на атомите. Това е най-разпространената група на сложни реакции между вещества - оксиди, основи, киселини и соли
От ZnO + H2SO4 = ZnSO4 + H2O
AgNO3 + KBr = AgVr + KNO3,
SrSl3 ZNaON + = Cr (ОН) 3 + ZNaSl.
Особен случай на тези обменни реакции - неутрализация
HCl + КОН = калиев хлорид + H2O.
Обикновено тези реакции са обект на законите на химично равновесие и потока в тази посока, където поне едно от веществата, отведена от зоната за реакция, както е газообразен, летливи вещества или утаяване malodissotsiiruyuschego (за решения) Съединение
NaHCO 3 + HCl = NaCl + H2O + CO2 ↑,
Са (HCO3) 2 + Са (ОН) 2 ↓ + = 2SaSO3 2H2O,
SN3SOONa + Н3РО4 + CH3COOH = NaN2RO4.
Въпреки това, много реакции, които не са подредени в горната проста верига. Например, химическа реакция между калиев перманганат (калиев перманганат) и натриев йодид не може да се дължи на някоя от тези видове. Такива реакции обикновено се нарича редокси например 2KMnO4 + 10NaI + 8H2 SO4 = 2MnSO4 + К2 SO4 + 5Na2 SO4 + 5I2 + 8H2 О.
Към редокси неорганична химия включва всички заместителни реакции и реакции на разпадане и тези съединения, в които играта на най-малко един прост вещество. В по-генерализирана изпълнение (вече предвид и органичната химия), всички реакции, включващи прости вещества. Напротив, реакциите протичат без да се променя степента на окисление на елементите, съставляващи реагентите и реакционните продукти включват всички реакционната обмен.
2. Класификация на реакции във фазата черта
В зависимост от състоянието на обединяване на реагентите са следните реакции:
1. реакции газ:
2. Реакциите в разтвори:
NaOH (воден) + HCI (р-р) = NaCl (р-р) + H2O (д).
3. реакции между твърди вещества:
СаО (твърдо вещество) + SiO2 (твърдо вещество) = SaSiO3 (TV).
3. Класификация на реакции в зависимост от броя на фазите
При фаза се разбере набор от еднородни части на системата със същите физични и химични свойства и са разделени един от друг чрез интерфейса.
Всички различни реакции, от тази гледна точка може да бъде разделен на две класи.
1. Хомогенен (еднофазна) реакция. Те включват реакции, проявяващи се в газова фаза, и различни реакции в разтвори.
2. хетерогенен (многофазни) реакция. Те включват реакции, в които реагентите и реакционните продукти са в различни фази. Например:
СО2 (г) + NaOH (р-р) = NaHCO 3 (р-р),
СО2 (г) + СаО (твърдо вещество) = SaSO3 (TV),
Na2SO4 (вод) + VaSl3 (р-р) = VaSO4 (TV) ↓ + 2NaSl (р-р),
Са (HCO3) 2 (вод) + H2SO4 (вод) = СО 2 (г) ↑ + H2O (ж) + SaSO4 (TV) ↓.
4. реакции Класификация на частици тип пренасяни
Прочетено: протолитично реакция
Информация за работата на "Концепцията за химически реакции и тяхната класификация"
Категория: химия
Брой знаци с интервалите: 20245
Брой на таблици: 2
Броят на изображенията 2
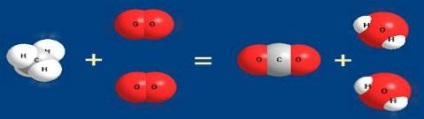
- реакцията става без да се променя степента на окисление: S + 4O4-2 + H2O → H2 + S + 4O4-2 CH3NH2 + HCl → (CH3NH3) СГ Както се вижда, има различни начини за класифициране на химични реакции, от които ние считаме по-подробно, както следва. Въз основа на промени в броя на началните и крайните материали. Там могат да бъдат намерени 4 видове химични реакции (Фигура 6): взаимодействие на съединение на реакцията на разлагане.
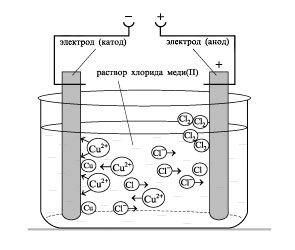
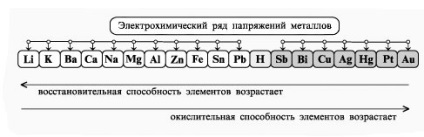
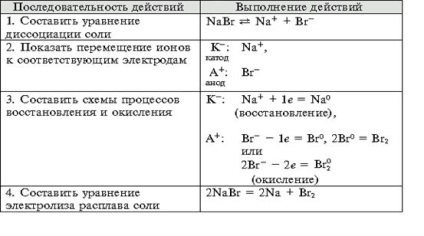
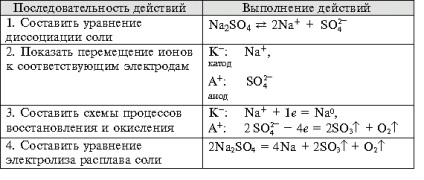
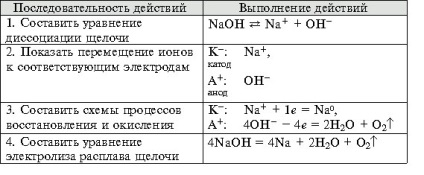
- Формиране на умения за експеримент технологии, способността за решаване на дизайн и качество на целите, за да се уравнението на химични реакции, протичащи в електролиза на решения и се топи elektrolitov.- организация образование независимост, формиране на умения за работа в група, развитие на творческите способности, логическо мислене, внимание и памет. Оборудване: компютър.
Реакционната среда в този случай зависи от съотношението на дисоциационните константи на съответните киселини и основи. Засилване на хидролиза може разреждане, отоплителна система. 2. химични реакции химическа реакция (химически явления) - процес, което води до някои вещества се превръщат в други. Признаци на химичните реакции са: - смяна на цветовете.
Свързани статии
