Един от най-разпространените методи химически практика ускоряване химични реакции е kataliz.Katalizator - вещество, което участва в няколко междинни етапи на реакцията, но оставя непроменени химически.
Например, реакция А2 + B2 = 2AV
За част на катализатора може да бъде изразена чрез уравнението
Тези уравнения могат да бъдат представени потенциални енергийни криви (Фиг. 5.2.).
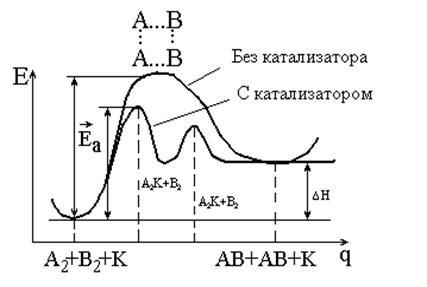
Фиг. 5.2. Схемата за енергийно реакция напредък
с катализатора и без катализатор
От Фигура 5.2 се вижда, че:
1) катализатор намалява енергията активиране чрез промяна на механизма за реакция - тя преминава през нови етапи, всеки от които се характеризира с ниска енергия активиране;
2) катализаторът не се променя реакции DH (както и DG, DU и DS);
3) ако катализира реакцията е обратима, катализаторът не се наруши баланса не променя постоянно равновесие и равновесните концентрации на компонентите на системата. Той е еднакво ускорява преки и обратни реакции, като по този начин ускоряване на времето за достигане на равновесие.
Очевидно е, че в присъствието на енергия активиране реакция катализатор се намалява от стойността DEK. Тъй като експресията на константата на скоростта на реакция (уравнение 5.10) енергията на активиране е включен в отрицателната степен, дори леко намаление Ea причинява много голямо увеличение на скоростта на реакцията :.
Ефект на катализатора за намаляване на ЕА е илюстриран от реакцията на разлагане на йодоводород:
По този начин, за намаляване на реакционната енергия
активиране на 63 кДж, т.е. 1.5 пъти, то съответства на увеличаване на скоростта на реакцията при 500 К в продължение на 10 6 пъти.
Трябва да се отбележи, че преди експоненциален фактор на реакция катализатор k0 k0 не е равно на 1, и обикновено е много по-малко, но съответно намаляване на скоростта не се компенсира за сметка на увеличаване на Да.
Пример 5. енергията на активиране на реакцията в отсъствието на катализатор беше 75.24 кДж / мол, и с катализатор - 50,14 кДж / мол. Колко пъти увеличава скоростта на реакцията в присъствието на катализатор, ако реакцията се провежда при 25 0 С и предварително експоненциален фактор в присъствието на катализатор се намалява с 10 пъти.
Решение. Ние означаваме активиране енергия на реакцията без катализатор от ЕА. и в присъствието на катализатор - от ЕА 1; подходяща реакция скоростните константи к е обозначен с к и 1. Чрез използване на Арениус уравнение (5.9) (вижте точка 5.3.) и като k0 1 / k0 = 10, намираме:
По този начин, намаляване на енергията на активиране 25,1 кДж катализатор доведе до увеличаване на скоростта на реакцията на 2500 пъти, въпреки 10-кратно намаление в предварително експоненциален фактор.
Каталитични реакции са класифицирани в зависимост от вида на катализатора и тип реакции. Например, състоянието на обединяване на реагентите и катализатори за хомогенна катализа разделен (катализатор и реагент за да се образува единична фаза) и хетерогенен катализатор (и реагенти - в различни фази, има граница фаза между катализатора и реагентите).
Примери на хомогенна катализа може да бъде окисление на СО да CO2 с кислород в присъствието на NO2 (катализатор). Механизмът на катализа може да бъде представен от следните реакции:
и катализаторът (NO2) отново участва в първата реакция.
По същия начин това може да се катализира от SO2 окислителната реакция да SO3; тази реакция се използва в производството на метод сярна киселина "Азот".
Един пример е получаването на хетерогенен катализатор SO3 от SO2 в присъствието на платина или V2 5:
Тази реакция също се използва в производството на сярна киселина (метод "контакт").
Хетерогенен катализатор (желязо) се използва също така при производството на амоняк от азот и водород, и в много други процеси.
Ефективността на хетерогенни катализатори обикновено са много по-голяма от еднородни. Скоростта на каталитични реакции в случай на хомогенен катализатор зависи от неговата концентрация и, в случай на хетерогенна - от неговата специфична повърхност (т.е., диспергиране) - колкото по-голям е, толкова по-висока скорост. Последното се дължи на факта, че каталитичната реакцията протича по повърхността на катализатора и включва етапите на адсорбция (слепване) реагенти молекули на повърхността; След реакцията, нейните продукти се десорбират. За да се увеличи катализатор повърхността на земята или получени чрез специални методи, които произвеждат много фини прахове.
Горните примери са също примери на редокси катализа. В този случай, да действат като катализатори обикновено преходни метали или техните съединения (Mn 3+. Pt, Au, Ag, Fe, Ni, Fe2 О3 т.н.).
На киселина-основа катализа на катализатор работи Н +. ОН - и подобни частици - носители на киселинност и алкалност. По този начин, реакцията на хидролиза
Това ускорено около 300 пъти чрез добавяне на всички силни киселини: солна киселина, HBr, или HNO3.
От голямо значение е катализа в биологичните системи. В този случай катализаторът се нарича ензим. Ефективността на много ензими, са много по-голяма в сравнение с конвенционалните катализатори. Например, за реакцията на свързване на азот на амоняк
Индустриална хетерогенен катализатор се използва под формата на гъба желязо с добавки на оксиди и метални сулфати.
Когато тази реакция се провежда при Т "700 и Р" 30 МРа. Същият синтеза е в нодули на бобови растения под действието на ензими по време на нормална Т и R.
Catalyst системи не са безразлични към примеси и добавки. Някои от тях се повиши ефективността на катализатор, като в горния пример желязо синтез на амоняк катализа. Такива добавки са наречени промотори в катализатора (калиеви и алуминиеви оксиди в желязото). Някои примеси, обратно, потискат каталитичната реакция ( "отрова" на катализатора), този катализатор отрови. Например, SO3 синтез на Pt катализатор е много чувствителен към примеси, съдържащи сулфидна сяра; Серни отрови повърхност платинов катализатор. За разлика от катализатор на базата на V2 О5 не е много чувствителен към тези примеси; развитие чест катализатор на основата на ванадий оксид принадлежи на руския учен GK Boreskov.
Свързани статии
