Както бе споменато по-горе, молекулите се състоят от атоми. Колко атома има различни видове, или, както ги наричат химични елементи.
Понастоящем известен елемент 102, който запълни клетките на периодичната таблица на Менделеев.
Всички различни вещества, които се виждат във външния свят, са оформени в полученото съединение един с друг в различни комбинации на тези химични елементи (атоми).
За удобство на написването на химическия състав на различни вещества и химичния им взаимодействие между химичен приета в легендата на всеки елемент се формират от началните букви на латинските наименования на тези елементи.
Латинският език, който първоначално е бил говорим език на древния Рим, а след това по време на Римската империя и по-късно, след падането на Римската империя, продължава да бъде използван от учените в Средновековието, а в някои науки, тя остава до момента.
Така че, в медицината латинския език, използван за имена на болести и наркотици в ботаниката - имена растителни.
Когато се срещате с въпросите за пречистване на водата са най-често срещаните химични елементи следните единайсет:
С тези символи (знака) на химичните елементи могат да бъдат представени от молекула на всяко вещество, и различни химични процеси.
Числото в долната дясна част на символа показва броя на атомите в молекулата. Например, химична реакция на изгаряне на горивото в котела може да бъде определен, както следва:
въглерод-кислород-въглерод диоксид, и гласи, както следва: за ТСЕ, плюс два равно на около два ТСЕ.
Първоначалните научни предположения за атома като неделими най-малките частици на материята са неправилни. В момента, физиците открили още по-малки елементарни частици, от които са изградени всички атоми. Такива основни частици има три протони, неутрони и електрони.
Според изследвания от последните десетилетия, в допълнение към тези основни частици от различни отворен много по-малки частици (позитрони, фотони, неутрино, мезони и др.), Които произтичат от радиоактивни разпадания и трансформации на материята.
Как да се изгради един атом на тези частици? В центъра на всеки атом е ядрото, състояща се от протони и неутрони. Около ядрото въртящ на различни разстояния от него (орбити) електрони, които са най-лесният от трите вида частици.
електрон тегло е 10 -27 грама Протон и неутрони имат почти същото тегло, около 1850 пъти по-тежък от електрони. Размери на протони, неутрони и електрони се изразяват в стотици хиляди акции на Angstrom.
Размерът на външната въртяща орбитата на електрони, и която по същество е размера на атом като цяло варира от 1 до 4, А. Следователно, голяма част от обема на атома е празна, не напълнена с материята.
Но ние не виждаме, не само от атоми, но също така и на молекули и поради това тялото около нас да ни изглежда изградена от твърда материя.
Основната маса на атома се концентрира в ядрото. Ако можехме да запълни 1 cm 3 протоните и неутроните като здраво, тъй като те са разположени в ядрата на атомите, а след това теглото на куба ще се равнява приблизително на теглото на най-високата планина Елбрус кавказки. Такава плътност е от значение в недрата на някои звезди.
Протони и електрони имат противоположен но равно количество електрически заряд: протона - положителен заряд, електрона - отрицателна. Неутроните нямат никаква електрически заряд.
Тъй като обикновено неутрален атом, броят на въртящ се около основните си електрони е равен на броя на протоните в ядрото. По този начин, всички известни различни химични елементи се различават един от друг по броя им са положително заредени протони ядра и равно количество, съответно въртяща се около тях в различни орбити на електрони.
Фиг. 3 показва опростена структура верига от атоми на някои елементи.
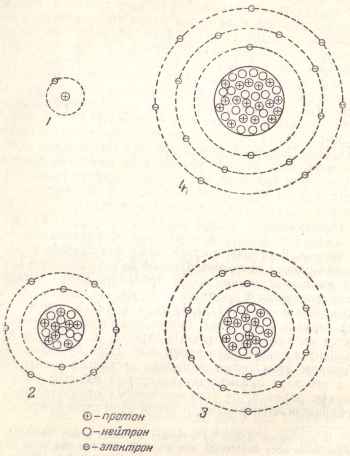
Фиг. 3. опростена схема структура на някои атоми: 1 - водород; 2 - кислород; 3 - натрий; 4 - хлоро.
водороден атом има един електрон, съответно, и това в основата си е протон. Ядрото на кислородния атом са осем протона и осем електрони го заобикалят, от които два електрона въртят по вътрешната страна на първия орбита, и шест електрони - от външната страна на втория орбита.
Натриев Y със сърцевина 11 и същия брой протони електрони последна разпределени на три орбити: първите - две електроните (както и на кислородния атом), а вторият - осем електрони и третия, външен, - един електрон.
Хлорен атом с протони в ядрото 17 има два електрони в първия орбитата на втория осем електрон орбита (същото като това на кислород и натрий) и седем електрони в третата орбита.
Установено е, че само определен максимален размер на електроните могат да бъдат настанени във всяка орбита. Първата орбита непосредствено заобикаля ядрото, могат да се настанят само два електрони, а вторият - осем, третият - осемнадесет четвърти - трийсет и две, петата - осемнадесет, и т.н. ...
В този случай всеки следващ електрон орбита може да бъде осигурена само, че всички предишни орбита максимално запълнени. Установено е, че всички от химичните свойства на елементи, определени от местоположението на неговите електрони и предимно електрони във външната орбита.
Тази зависимост е изобретателно да се предвидят голям руски учен Менделеев в периодичната система на елементите, при което броят на последователност показва позицията на номера на елемент на електрони на атом. и в една и съща колона на таблицата са атоми със същия брой електрони в най-външния орбита.
Тъй насипно се концентрира в ядрото на атома, а след нейното тегло определя от теглото приблизително ядро, състояща се от протони и неутрони. неутрони тегло е малко по-различен от теглото на протона.
Броят на неутроните в ядрото на един атом е броят на протоните или леко надвишава. Така атомно тегло определя от броя на протоните и неутроните в ядрото и следователно се нарича масовото число на атома.
Понастоящем дефинирани абсолютни тегла на различни атоми, те са експресирани в много малки количества. Например, ако вземете дори най-тежката атом - уран, теглото му е само 0,4H10 -21грам
Разбира се, да се справят с такива стойности в изчислението е много неудобно. Следователно, в конвенционална химия прие специална мярка от теглото на атома, равно на теглото на леките от тях - водороден атом, теглото на който се приема за 1.0, и след това теглото на всички други атоми показва колко пъти те са по-тежки от водородния атом.
Понастоящем единица атомни тегла приет 1/16 атомното тегло на кислород, което е по-удобно, тъй като в този случай атомни тегла на много елементи са близки до числа. Но тогава атомното тегло на водород е равна на 1008; за грубо изчисление, че може да се приравни до 1.0.
Свързани статии
