Вода, е много слаб електролит, дисоциира в йони в много малка степен:
Този процес е описан от равновесната константа на равновесие:
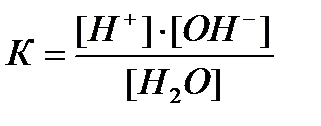
където К - константа на дисоциация на водата. На 22 0 С е равно на 1.8 # 8729; 10 -16.
Тъй като степента на дисоциация на вода е много малък, уравнението (1) концентрацията на вода [Н 2О], може да се разглежда като постоянна стойност
,
където кВт - йонна продукт на вода.
Заместването на стойностите на К и [Н 2О] в уравнение (2) получаваме цифровата стойност на йон продукта от вода при 22 0 С
Kw = [Н +] [OH -] = 1,8 # 8729; 10 -16 # 8729; = 10 -14 55.56
KW зависимост от температурата е показана чрез следните данни:
Т, С 0 10 22 30 50 100
KW 0.36 х 10 -14 1,00 х 10 -14 1,89 х 10 -14 5,6 х 10 -14 74 х 10 -14
По този начин, KW - постоянна стойност само когато дадена температура.
Разтвори, в които концентрацията на водородните йони и хидроксилни йони са равни, наречени неутрални разтвори. В 22 0 ° С в неутрални разтвори като концентрацията на водородните йони и хидроксилни йони е 10 -7 мол / л. В киселинни разтвори над концентрацията на водородните йони в алкална - концентрацията на хидроксидни йони. Но независимо от разтвор на реакционния продукт на концентрацията на водородните йони и хидроксид - йон остава постоянна.
От това следва, че степента на киселинност и степен на алкалност на разтвора може да се изрази чрез концентрацията на йони Н + или ОН -:
Неутралният разтвор [Н +] = 10 -7 мол / л,
Киселият разтвор [Н +]> 10 -7 мол / л,
Алкалният разтвор [Н +] <10 -7 моль/л.
За да се избегнат неудобствата, свързани с използването на номера с отрицателни експоненти, концентрацията на водородните йони обикновено се изразява чрез стойността на рН и обозначен с рН на символ.
РН наречената логаритъм на концентрацията на водородните йони, взети с обратен знак:
рН-LG [Н +] и [Н +] = 10 -Ph
където [Н +] - водород йонна концентрация, мола / литър.
Хидроксилно индекс Poh наречен логаритъм на концентрацията на хидроксидни йони, взети с обратен знак:
Poh = - LG [OH -] или [OH -] = 10 -rON
където [OH -] - концентрация на хидроксилни йони мол / л.
рН + Poh = 14; Poh = 14 - рН.
Ясно е, че връзката между концентрацията на водородните йони, стойността на рН и реакционният разтвор може да се изрази в диаграма

Схемата показва, че понижаване на рН, по-голяма от концентрацията на Н + йони. т.е. висока киселинност; Обратно, по-голяма стойността на рН, по-ниска от концентрацията на Н + йони. т. е. по-висока алкалност.
Свързани статии
