Ion и метална връзка. Йонийски и метални кристали
Йонната връзката се осъществява чрез електростатично привличане между противоположно натоварени йони. Тези йони се образуват чрез електронен трансфер от един атом на друг. Йонийски връзка, образувана между въглеродните атоми, имащи големи електроотрицателност разлики (обикновено по-голяма от 1,7 по скалата на Полинг), например, между атоми на алкални метали и халогени.
Разгледа настъпването на образуване йонна връзка например NaCl.
Тъй електронни формули атома
Na 1s 2s 2 2 2p 6 3s 1 и
Cl 1s 2s 2 2 2 2p 6 3s 3P 5
Това показва, че за завършване на външната нивото на натриев атом, за да се получи по-лесно един електрон от седем придават и хлорен атом е по-лесно да се прикрепят една от седем до получаване. Химическите реакции на натриев атом дава един електрон и отнема хлорен атом. В резултат на електронен слой на натриеви и хлорни атоми са превърнати до електронна стабилност благороден газ (електронна конфигурация натриев катион
Na + 1s 2s 2 2 2p 6.
Електронната конфигурация и хлор анион
Cl - - 1s 2s 2 2 2 2p 6 3s 3P 6).
Електростатично взаимодействие между йон на молекулата води до образуването на NaCl.
Естеството на химичната връзка често се отразява в състояние на агрегиране и физични свойства на веществото. Йонни съединения като натриев хлорид NaCl, и твърди огнеупорен поради техните йони между такси "+" и "-" са мощни сили на електростатично привличане.
Отрицателно заредените хлорен йон привлича не само "" йон Na +, но също така и други натриеви йони около тях. Това води до факта, че почти всички йони не е единичен йон с противоположен знак, и повече.
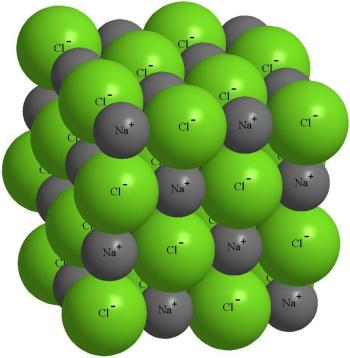
Структурата на кристала на сол NaCl.
В действителност, за всеки 6 е хлорен йон, натриев йон, натриев йон около всеки - 6 хлорни йони. Такова подредени пакетиране на йони се нарича йонна кристал. Ако кристала разпределят отделна хлорен атом, сред околните натриеви атоми вече не е възможно да се намери един, с които взаимодейства хлор.
Се привличат една към друга чрез електростатични сили, йоните са изключително склонни да променят позицията си под въздействието на външна сила или температура на увеличение. Все пак, ако на натриев хлорид и да продължи да се загрее стопилката във вакуум, след това се изпарява до получаване на молекула, молекула NaCl. Това предполага, че силата на ковалентна връзка никога не е изключена напълно.
Основни характеристики на йонни връзки и йонни свойства на съединенията
1. йонна връзка е силна химична връзка. Енергията на тази връзка е от порядъка на 300-700 кДж / мол.
2. За разлика от ковалентна връзка, йонна връзка е индиректно, защото йон може да привлече йони на обратен знак във всяка посока.
3. За разлика от ковалентна връзка, йонна връзка е ненаситен, като взаимодействието на обратен знак йони не води до пълно взаимно компенсиране на техните силови полета.
4. По време на образуването на йонни връзки с молекули не пълен трансфер на електрони, така че абсолютната йонна връзка не съществуват в природата. NaCl молекула химичната връзка е само 80% йонен.
5. Съединения с йонна връзка - са твърди кристални вещества с висока температура на топене и температурата на кипене.
6. Повечето от йонни съединения се разтварят във вода. Разтвори или стопилки на йонни съединения провеждат електричество.
За разлика разположени метални кристали. Ако ние считаме, парче от метален натрий, се установи, че външния вид е много различен от готварска сол. Натриев - лек метал, лесно да се реже с нож, сплескана с чук, може да се стопи лесно в чашата на спирт (температура на топене 97.8 ° С). Кристалът натрий на атом е заобиколен от осем други такива атоми.
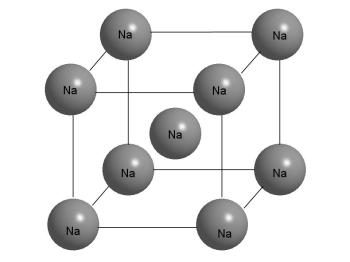
Кристалната структура на Na метал.
Фигурата показва, че Na атом в центъра на куба има осем-близките съседи. Но Същото може да се каже на други атоми в кристала, като всички те са еднакви. Кристалът се състои от "безкрайно" повтарящи се единици, показани на тази фигура.
метални атоми на нивото на външната енергия, съдържат малък брой валентните електрони. Тъй като йонизация енергията на металните атоми е малък, електроните валентните слабо задържани в тези атоми. В резултат на това в кристалната решетка на метали изглежда положително заредени йони и свободни електрони. Където метални катиони са в кристалната решетка и електроните свободно се движи в положителните центрове, които са така наречените "електронен газ".
Наличието на катиони между отрицателно заредените електрони води до че всеки катион взаимодейства с електрон.
По този начин, метален връзка - е връзката между положителните металните йони в кристалите, което се извършва чрез привличане на електроните, които се движат свободно в кристала.
Тъй като електроните валентност в метала са равномерно разпределени в цялата метална връзка кристалната като йон е индиректно комуникация. За разлика от ковалентна връзка, метален връзка е ненаситена връзка. Чрез ковалентна връзка сила метален връзка също се различава. Енергията на свързване на метала е около три - четири пъти по-малка от енергията на свързване на ковалентна.
Поради високата мобилност на метали електрон газ се характеризират с висока електрическа и топлинна проводимост.
Metal кристал изглежда достатъчно проста, но в действителност на електронна му устройство е по-сложно от това на кристали на йонни соли. На външната електрони обвивка на металните елементи, не е достатъчно електроните да образуват пълен "октет" ковалентни или йонни връзки. Следователно, в газообразно състояние се състои от по-голямата част от метални едноатомен молекули (т.е. индивида, несвързани атома). Типичен пример - живачни пари. По този начин, метален връзката между металните атоми среща само в течно и твърдо състояние на агрегиране.
Описва метален връзка може да бъде, както следва: парче метални атоми в Полученият кристал се дава в пространството между неговите валентните електрони с атома (за натрий е 3s1.), Превърната в йони. Тъй като всички метални атоми в кристала са идентични, като всеки има равни шансове за загуба на друга валентност електрон.
С други думи, на прехода електрони между неутрални и йонизирани метални атоми става без енергия. Някои от електроните по този начин винаги се появява в пространството между атомите във формата на "електронен газ".
Тези свободни електрони, на първо място, притежават металните атоми в определен равновесие разстояние един от друг.
На второ място, те дават характерни метали "метален гланц" (свободни електрони могат да взаимодействат със светлина кванти).
На трето място, електрони метълс свободните осигуряват добра електрическа проводимост. Висока проводимост метали топлина също се дължи на присъствието на свободни електрони в interatomic пространство - те са лесни за "отговор" да промени в енергия и насърчаване на бързото му преместване на кристала.
Опростен модел на електронната структура на метал кристал.
** ** ** ** разгледаме например естеството на метален натрий с метални перспектива връзка представителства на атомна орбитала на. На натриев атом, както и много други метали, има липса на валентните електрони, но са свободна валентна орбити. Единственият 3s-електрон натрий възможност да се движи и да е от наличните тези на съседните енергийни орбитали. При приближаване атомите в кристала външните орбитали на съседни атоми се припокриват, така дари електрони се движат свободно в кристала.
Въпреки това, "електрон газ" не е разхвърлян колкото може да изглежда. Безплатни електроните в метален чип са на припокриващите орбитите и поне някои от тях са споделени, образувайки един вид ковалентни връзки. В натрий, калий, рубидий и други метални елементи социализирани S-електрони достатъчно, така че техните кристали са крехки и разтопими. С увеличаване на броя на валентен електрон на метали сила като цяло се увеличава.
По този начин, метален връзка, са склонни да образуват елементи, чиито атоми външната черупки имат малки валентните електрони. Това валентност електрон провеждане метален връзка, социализирани, така че те могат да се придвижват металните кристалите и да се осигури висока проводимост метал.
Crystal NaCl не провежда електрически ток, тъй като пространството между йоните има свободни електрони. Всички електрони гласове натриев атом, за себе си твърдо държат хлорни йони. Това е един от съществените разлики на йонни кристали от метал.
Това, което сега знаем за метални връзката, и помага да се обясни с висока податливостта (пластичност) на повечето метали. Metal може да изравнявам на тънък лист, разтегателен тел. Фактът, че отделните слоеве на металните атоми в кристала може относително лесно да се плъзгат един върху друг: подвижна "електрон газ" омекотява непрекъснато преместване отделни положителни йони, като ги защитава от друг.
Разбира се, нищо такова не може да се направи с готварска сол, но солта - също е кристално вещество. В йонни кристали, валентните електрони са силно свързани с ядрото на атома. Промяната на един спрямо друг слой на йони води до сближаването на йони от същия заряд и причинява силно отблъскване между тях, в резултат на разрушаване на кристала (NaCl - крехък материал).
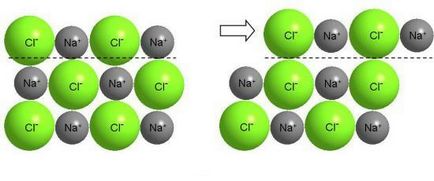
Промяната на слоевете на йонна кристал причинява големи сили на отблъскване между йони на същото име и унищожаването на кристала.
Свързани статии
