рецептор на инсулина (IR) (Eng инсулин рецептор.) - трансмембранен рецептор. който се активира от инсулин. IGF-I. IGF-II принадлежи на голям клас на рецепторни тирозин кинази [1]. Метаболитно, инсулинов рецептор играе ключова роля в регулирането на глюкозната хомеостаза, функционален процес, който в дегенеративни условия може да доведе до редица клинични прояви, включително рак и диабет [2] [3]. Биохимично инсулин рецептор се кодира от единичен ген INSR, алтернативен сплайсинг време на транскрипцията на която произвежда или на IR-A или към изоформа на IR-В [4]. Следващите посттранслационни събития всяка изоформа води до образуването на протеолитично разделяне-α и Р-субединици, които, когато се комбинират, в крайна сметка ще способен на димеризация до получаване дисулфид свързан трансмембранен инсулин рецептор тегло ≈ 320 Ша [4].
Първоначално транскрипти INSR са преведени алтернативни снадени варианти на гена за производство на една от две мономерни изомер: IR-A, в която екзон 11 се нарязва и IR-B, където екзон е екзон 11. Включването на 11 до 12 аминокиселини води до добавянето над фурин протеолитичен сайт разделяне.

Цвят-схемата за кодиране на инсулиновия рецептор
Когато рецепторна димеризация, след протеолитично разцепване на а- и Р-вериги, са допълнителни 12 аминокиселини в С-края на α верига (означена αCT), където те вероятно да повлияе на взаимодействието на рецептор и лиганд [5].
Всеки мономер структурно изомерна разделена на 8 различни домейни; левцин обогатен повторения домейни (L1, остатъци 1-157) богат на цистеин област (CR, остатъци 158-310), допълнителните левцин обогатен повтаря домейни (L2, остатъци 311-470), три типа фибронектин III домейн; FNIII-1 (остатъци 471-595), FNIII-2 (остатъци 596-808) и FNIII-3 (остатъци 809-906). Освен това, областта на вмъкване (ID, остатъци 638-756), разположени в FNIII-2, съдържащ сайта на разцепване α / β фурин, които действат като протеолиза в IDα и IDβ домени. В β-верига, по-долу областта FNIII-3 е трансмембранен спирала и вътреклетъчния юкстамембранната област, непосредствено над вътреклетъчен тирозин киназа каталитичен домейн отговорен за активиране на вътреклетъчните сигнални пътища [6]. Чрез разделяне на мономер, съответстваща на а и рецептор хомо- β верига или хетеродимеризират чрез ковалентна дисулфидна връзка между мономерите и образуват две дисулфидни връзки, всеки простиращ се от α-веригата в димер. Общата структура на 3D ектодомен [ен]. има четири свързващ лиганд сайтове, прилича на обърната V. Всеки мономер се завърта около 2 пъти около ос, преминаваща успоредно на обърнато V. L2 и FNIII-1 домени на всеки мономер, образуващи горната част на обърнато V [6] [7].
Ендогенен инсулин рецепторни лиганди включват инсулин. IGF-I и IGF-II. Свързването на лиганд към веригите на α-IR ектодомен причинява структурни промени в рецептора, което води до различен автофосфорилиране на тирозинови остатъци в вътреклетъчния домен в TK β верига. Тези промени sposobstvovuyut набиране на специфични адапторни протеини [ен]. протеини, такива като инсулин рецептор субстрат (IRS) в допълнение към SH2-B [ен] (Src хомолог 2 - В), APS и протеин фосфатази, като например РТР1В [ен]. евентуално допринася за последващите процеси, включени в хомеостазата на кръвната захар [8].
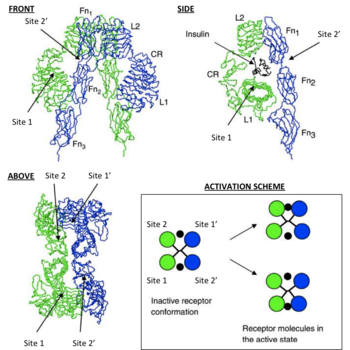
Диаграма, показваща потенциалните места на свързване за IR
Строго погледнато, връзката между комплекс алостерични свойствата на инсулин рецептор и лиганд покажи. Това се показва чрез Scatchard на график [ен], което показва, че измерената стойност на инсулиновия рецептор, свързан с лиганд, по отношение на несвързания лиганд не трябва да бъде линейна функция по отношение на промени в концентрацията на инсулин рецептор, свързани с лиганд, дава основание да се предположи, че инсулин рецептор и лиганд взаимодейства в механизъм съвместно свързан [ен] [9]. В допълнение, наблюдението, че скоростта на дисоциация IR-лиганд увеличава с добавянето на несвързания лиганд предполага, че естеството на това сътрудничество е отрицателен; С други думи, първоначалното свързване на лиганда с инфрачервено инхибира допълнително свързване с второ активно място, което показва алостеричен инхибирането на [9].
Въпреки че точният механизъм на IR свързване към неговия лиганд е структурно все още не е изяснен, от гледна точка на системи биология на. биологично значими кинетика прогнози [EN] IR-лиганд (инсулин / IGF-I) е определена в контекста на наличните структури ектодомейна IR [6] [7].
Тези модели твърдят, че всеки мономер е 2 IR инсулин свързващ сайт; Site 1, който се свързва с "класически" повърхност свързване на инсулин. състояща се от L1 плюс αCT домейн и място 2, състояща се от бримките на кръстопътя FNIII-1 и FNIII-2, прогнозира да се свързва с "нов" лице сайта на свързване хексамерен инсулин [1]. Тъй като всеки мономер осигурява IR ектодомен представяне 3D «огледало" комплементарност, N-краен сайт 1 от един мономер в крайна сметка е обърната към С-терминалния сайта 2 на втория мономер, който също е вярно за всяко огледало мономери комплемент (противоположната страна на структурата на ектодомен) , Текущ литература отличава допълнения свързващи места, присвояване сайт 1 и 2 мономерни добавки обекти, 3 и 4, или като място 1 'и 2', съответно [1] [10].
По този начин, тези модели твърдят, че всеки IR може да се свързва с молекула на инсулин (който има две свързващи повърхност) в 4 места от сайтове 1, 2, (3/1 ") и (4/2"). Тъй като всеки сайт 1 проксимално лице със сайта 2 се очаква да стане свързващ сайт инсулин специфичен "подшиване» [ен] от лиганд между мономери (т.е. [мономер един сайт 1 - инсулин - мономер 2 място (4/2 " )] или [1 сайт мономер 2 - инсулин - мономер 2-място (3/1 ")]). В съответствие с математическо моделиране на IR-инсулин кинетика, има две важни последици за омрежване на събитията от инсулин; 1. В горната наблюдение на отрицателен IR взаимодействие и неговия лиганд при свързване на лиганд към спад IR и 2. физически експозиция води до омрежване на ектодомейна в конформация, която е необходима за началото на вътреклетъчната тирозин фосфорилиране събития (т.е. тези събития са изискване за рецепторното активиране с последвано от поддържане на хомеостазата на кръвната захар) [8].
Рецепторните тирозин кинази [EN]. включително инсулин рецептор, медиира тяхната активност чрез предизвикване добавянето на фосфатна група към специфичен тирозин в клетки на някои протеини. На "основа" протеини, които са фосфорилирани от инсулиновия рецептор съдържа протеин, наречен «IRS-1" за "инсулинов рецептор субстрата 1. Свързването и фосфорилиране на IRS-1 в крайна сметка води до увеличаване на висок афинитет молекули глюкозен транспортер (GLUT4) във външната мембрана на инсулиновата чувствителност на тъканите, включително мускулни клетки и мастната тъкан. и, следователно, да се повиши абсорбцията на глюкоза в кръвта в тези тъкани. С други думи, GLUT4 мехурчета глюкозен транспортер транспортирани от клетка в клетка повърхност, където тя може след това да бъде посредник в транспорта на глюкоза в клетката.
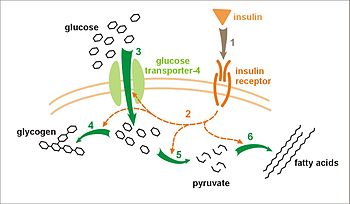
Ефект на инсулин на поглъщането на глюкоза и метаболизъм. Инсулинът се свързва с неговия рецептор (1), който, от своя страна, води до активиране на няколко протеинови каскади (2). Това са: транслокация Glut-4 транспортер на плазмената мембрана и глюкоза поток (3), синтезата на гликоген (4), гликолиза (5), синтез на мастни киселини (6).
Основната активност на активирането на инсулиновия рецептор - индуцирана поглъщането на глюкоза. Поради тази причина, "инсулин нечувствителен" или намаляване на инсулин рецепторната сигнализация води до диабет тип 2 - клетки не са в състояние да поемат в резултат на глюкоза и - хипергликемия (увеличение глюкоза циркулация) и всички последствия от диабет.
Няколко пациенти с хомозиготна мутация INSR гени са описани като се получи синдром Donohue [ен]. Това е автозомно-рецесивни заболявания правят абсолютно нефункционални инсулиновите рецептори. Тези пациенти имат по-ниско разположени, често изпъкнали, уши, нос, дебели устни и силно забавяне на растежа. В повечето случаи прогнозата за тези пациенти е изключително беден, фаталност се случва по време на първата година от живота. Други мутации в същия ген причиняват по-малко тежък синдром на Robson-Mendenhall [ен]. при което пациентите се характеризира с ненормални зъбите, венците и хипертрофична разширяване епифизната жлеза. И двете заболявания са fluktatsiyu глюкоза: глюкоза първоначално много висока постпрандиална, и след това рязко пада до необичайно ниски нива [11].
Регламент на генната експресия
Активният IRS-1 функция като втори месинджър в клетка да стимулира транскрипцията на гени insulinoreguliruemyh. Първо, протеин Grb2 свързва P-Tyr IRS-1 остатък в SH2 домен [ен]. Grb2 става в състояние да се отнасят SOS, което от своя страна катализира замяната на БВП с GTP свързан с Ras, G-протеин. Този протеин след това започва каскада на фосфорилиране, което води до активиране на протеин киназа mitogenoaktiviruemoy (МАРК), който влиза в ядрото и фосфорилира различни транскрипционни фактори ядрен (например, Elk-1).
Стимулирането на синтеза на гликоген
Гликоген синтеза и стимулирани инсулин рецептор чрез IRS-1. В този случай, това SH2 домейни [ен] на PI-3 киназа (PI-3K [ен]), която се свързва P-Tyr на IRS-1. Сега активира PI-3K може да конвертира липидна мембрана фосфатидилинозитол 4,5-бифосфат [ен] (PIP2) до фосфатидилинозитол 3,4,5-трифосфат [ен] (PIP3). Това индиректно активира протеин киназа РКВ (Akt) чрез фосфорилиране. след РКВ фосфорилира няколко целеви протеини, включително гликоген синтаза киназа 3 [ен] (GSK-3). GSK-3 е отговорен за фосфорилиране (и следователно деактивиране) гликоген синтаза. Когато фосфорилира от GSK-3, е забранено предотвратявайки дезактивирането на гликоген синтаза. Това отклонение инсулин увеличава синтеза на гликоген.
След молекулата на инсулин се свързва към рецептор и го активира, той може да бъде освободен в извънклетъчната среда, или може да се разгражда в клетката. Разграждане обикновено включва ендоцитоза на инсулин-рецепторен комплекс, последвано от ензим, който разрушава инсулин. Повечето инсулинови молекули се разграждат от чернодробните клетки. Изчислено е, че типичен инсулинова молекула се разгражда след около 71 минути след първоначалното освобождаване в кръвния поток [12].
Свързани статии
