Съгласно химична връзка реализират различни видове взаимодействия, което води до стабилна наличието на ди- и поливалентни съединения: молекули, йони, кристални вещества. По своята същност, химичната връзка е взаимодействие между положително заредените ядра и отрицателно заредени електрони и електрона един с друг. Основните видове химични връзки: ковалентна, йонна метал. За да се опише ковалентна връзка, използвайки два метода - метода на валентните връзки (МВС) и метода на молекулни орбитали (IMO).
В основата на метода на слънце, се основава на следните разпоредби:
1. В образуването на ковалентна връзка, включващи само два несдвоени електрони атоми с срещу завъртане (обмен механизъм на образуване на връзка), или един електронна двойка на атома
- донор и свободен орбитален от друг атом - акцептор (донор-акцептор механизъм).
2.Kovalentnaya химична връзка между два атома се появява в резултат на припокриването на атомна орбитала за образуване на електрони двойки (социализация два електрони).
Според валентността теория връзка, ковалентна връзка, е насочено към максималната припокриването на атомна орбитала на взаимодействащите атоми.
Геометрична (пространственото) структура на молекула, състояща се от повече от два атома поради взаимното разположение на атомни орбитали, участващи в образуването на химически връзки. АВ2 молекула може да бъде линейна. или ъгловата структура (а). AB3 молекула може да бъде под формата на равностранен триъгълник (б), триъгълна пирамида (с). Молекула AV4 - тетраедър форма (с).
Пространствената структура на молекулата определя от вида на хибридизация валентните орбитали на централната атом и броя на самотните електронни двойки, съдържащи се в валентност електрон слой.
Пример 1. Описва се метод от гледна точка на структурата на валентна връзка от молекули: а) PH3. б) BBr3. Какво атомната орбитали участва в образуването на химичните връзки? Посочете вида на хибридизация (ако настъпи хибридизация). Какво е пространствената структура на тези молекули?
Решение. а) молекула образование PH3.
Ние напиши електронните Формула атоми, образуващи молекула рН 3, предимно (нормално) състояние 15 P 2s 1s 2 2 2 2p 6 3s 3P 3; 1 H 1s 1
Electron графични формули външния слой на атома:
В тази молекула, централната атом е фосфорен атом, при което образуването на три химични връзки участват само р - орбитите разположен върху един подслой и с една и съща форма и същата енергия. Следователно, в молекула, хибридизация PH3 в режим офлайн.
За да се визуализира на схемите за валентност, можете да използвате следния метод. Електроните на външната електрон слой, обозначени с точка, са разположени около химически символ на атома. Общото за двата атома електрони показват точки са поставени между техните химически символи; двойна или тройна връзка, съответно, е обозначен с две или три двойки общи точки. Използвайки тези обозначения, образование Ph3 молекули могат да бъдат представени, както следва:
Тази схема може да бъде написана по различен начин: N - P - Н, където всяка двойка електрони, свързваща два атома съответства на пробив представлява ковалентна връзка в структурните формули.
р - електронни облаци фосфорни атоми са ориентирани в взаимно перпендикулярни посоки (по оси координира) -rh. PV. ЗЗ и имат форма гира. Y водороден атом в химическата свързване участва P-Н а-електронен облак със сферична форма. Когато образуването PH3 молекула настъпва припокриване р - електронни облаци фосфорен атом с S-електрон облаци на три водородни атоми:
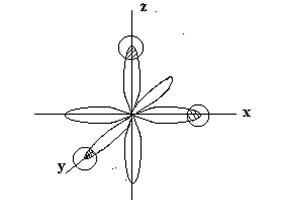
В съответствие с метода на валентността слепя три връзки
F - Н трябва да се намира в близост до ъгъл 90 ° С. Следователно, пространственото подреждане на единичните връзки определя геометрична структура на молекулата. PH3 молекула трябва да има форма на триъгълна пирамида:
На върха на пирамидата е фосфорен атом и база върховете водородни атоми.
б) молекула образование BBr3. Молекулата BBr3 централната атом е борен атом.
Електронни атома с формула:
5 1s 2s 2 2p 2 1 35 2 Br 1s 2s 2p 2 6 2 3s 3P 6 3d 10 4S 2 4P 5
Електрон графичен формула външен слой има формата:
Тъй като борен съединението е тривалентен, напиши електронен графичен формула борен атом във възбудено състояние:
Образуването на три химични връзки в молекулата BBr3 участва една от S- и р-орбитите на две, разположени на различни под-нива и с различни форми и различни енергии:
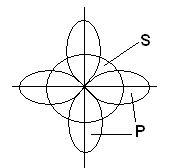
В този случай, вместо на оригиналната два аудио S- и р-орбитите на възбуден борния атом, образуван от трите еквивалентни хибридни орбитали (SP 2 - хибридизация). Когато SP 2 хибридизация хибриден електронни облаци са разположени в направления, лежащи в една равнина и ориентирана под ъгъл от 120 ° помежду си:
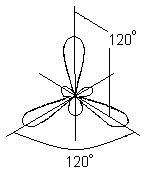
Този тип съответства на образуването на хибридизация плосък триъгълна молекула. Когато образуването на ВВг3 молекула настъпва припокриващи три хибридни орбитали борен атом с р - електрон орбитали на три атоми бром:
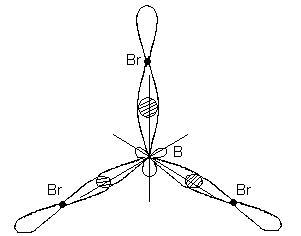
BBr3 молекула има формата на плосък правоъгълен триъгълник, чийто център е борен атом, а отгоре - с бромни атоми. Всички три комуникация-Br молекула BBr3 равни.
молекула образуване Пример 2. Draw мощност верига и F2 F2 + молекулен йон по метода на молекулни орбитали. Колко електрони са в лепене и antibonding орбитите на? Какъв е редът за връзка в тези частици? Посочете техните магнитни характеристики (парамагнетизъм или диамагнетизъм).
Решение. Според теорията на молекулни орбитали (IMO) молекула се счита за събиране на положително заредените ядра и отрицателно заредени електрони, всеки електрон движи в друга на електроните и ядрата на всички.
Опишете молекула според MMO на теория - това означава да се определи вида на своите орбити и тяхната енергия и да разберете характера на разпределението на електрон от орбитите.
При образуването на молекула, имаща молекулно орбитите на два вида - свързващи и дезинтегриращи. Ако образуването на молекули от атоми на прехода на електрон на молекулно орбитала ще бъде придружено от намаляване на енергия, като молекулно орбитален се свързване. Ако прехвърлянето на електрон да молекулно орбитален е придружен от повишена енергия, като молекулно орбитален се antibonding.
Електроните в молекулите разположени на S- и р-молекулни орбитите. S-орбитали могат да бъдат образувани чрез припокриване е - припокриване на атомна орбитала и 2px - атомна орбитала. В тази форма молекулни орбитали: S-свързване (SSV) и S-дезинтегриращи (srazr). Когато припокриващи 2py и 2rz атомна орбитала са оформени молекулни орбитали: psv2Ru. psv2Rz и praz2Ru. praz2Rz. Редът на поставяне на електроните в молекулни орбитали е същият, както в случая на атомни орбитали, който е в съответствие с принципа на минималната енергия, принципът на изключване Pauli, правило Hund на.
Свързани статии
