Повечето от химичната реакция, не се случва до края. Реакциите, които могат да се провеждат едновременно в две противоположни посоки, наречени обратими. Ако скоростта на такива реакции стотина нахут равни,
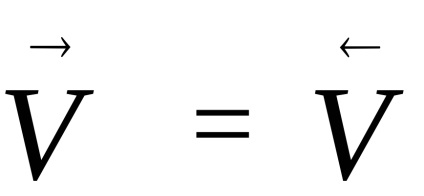
равновесно състояние, характеризиращо се с степента, до която в даден реакцията на обстоятелства-ТА, веднъж започнал, протича естествено (ΔG <0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарно-изотермического потенциала происходить не будет (см. рис.1)
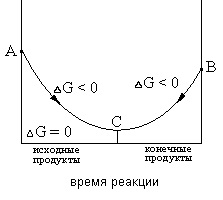
Промяната ΔG Фиг.1 като поток реакционната

За хомогенна обратима реакция аа + BБутон включено

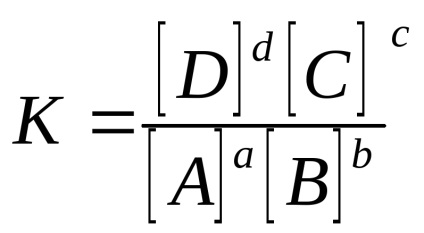
в случай на газови системи:
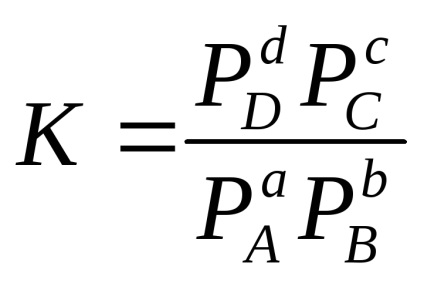
Например, за реакцията:
Отличителна черта на хетерогенен химичен равновесие е липсата на равновесие константи на държавите-членки по отношение на твърдите вещества.
При тази температура, реагенти частични налягания, намиране-schihsya в кондензира (твърди или течни) състояние, са постоянни и не зависят от количеството на реагенти. Поради това тези парциални налягания обикновено включват постоянно равновесие. Така, реакцията
СаСО3 (т) = CaO (и) + CO2 (г);
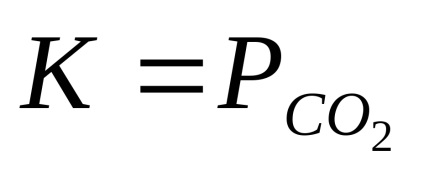
Равновесната константа е свързано с промяна в изобарно-изотермично потенциал химична реакция ΔG ° връзка:
Тъй ΔG ° = ΔNº - TΔS °; RlnK = ΔS ° - ΔNº / T
следователно К = д -Δ Н º / RT д Δ S º / R
В условията на равновесие на обратима реакция ΔG ° = Н ° - T · ΔS ° = 0 може да се изчисли температурата, при която е равновесие
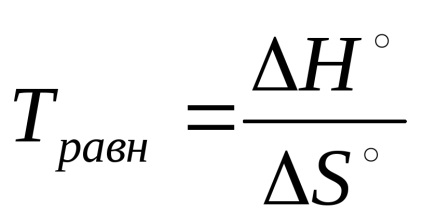
От тези уравнения следва, че константата на равновесие е много чувствах-ING към промените в температурата. Ефектът на равновесната константа при доставяне на реагентите определя зависимостта на енталпията (ΔNº) и ентропия (ΔS °) фактори.
Концентрацията на реагентите и налягането (ако не е много сезон нещо), равновесната константа е независима. При промяна на условията (температура, налягане ТА, концентрация) равновесното състояние е нарушен.
Промяна в съотношението, в зависимост от условията на климата в общ принцип Льо Шателие като: Ако системата е в равновесие, да окаже влияние отвън чрез промяна на някое от условията, които определят баланса, тя се измества в посока на потока на процес, който води до отслабване на ефекта произведен чрез действието. Следователно, увеличаването на температурата измества равновесието към ендотермичен процес и намаление - в посока на екзотермичен процес. Като се има предвид, че? Н = -Q
RlnK = ΔS ° + Q / T (екзотермична реакция).
RlnK = ΔS ° - Q / T (за ендотермични реакции).
Като цяло, в области, характеризираща се с висока температура ендотермична реакция параметър, и при ниски температури - екзотермична. Налягане розово shenie измества равновесието към образуване на малки ко-lichestva газови молекули, увеличаване на концентрацията на изходните материали - в посока на образуване на реакционните продукти. В противоположния баланс въздействие ще бъдат изместени съответно в странична Obra mations изходни материали. Например, за екзотермичната реакция
.
за равновесието към образуване на амоняк е необходимо да се увеличи концентрацията на изместване на изходните материали (с най-изгодно да се увеличи концентрацията на водород), за да се намали концентрацията на амоняк за да се намали температурата или увеличаване на налягането.
Адсорбция - процес абсорбция една повърхност от другите вещества поради некомпенсирани силови полета частици в повърхностния слой (в интерфейса).
Веществата, които се абсорбират от частиците (газ, течности, разтворени компоненти) нарича адсорбата и абсорбер - адсорбента.
Взаимодействието между частиците на адсорбента адсорбат и може да се променя. В зависимост от естеството на това взаимодействие се разграничат физическа и химическа адсорбция (хемисорбция).
В физическа адсорбция на адсорбат и частици адсорбент свързват относително слаби междумолекулни сили взаимодействия (Ван дер Ваалс сили). Пример за физическа адсорбция е адсорбция на газове или разтворени вещества активен въглен.
В хемисорбция на адсорбат и частици адсорбент са свързани силни адхезионни сили, настъпили вследствие на химични взаимодействия, водещи до образуването на нов материал. Пример за хемисорбция може да служи като адсорбция кислород метали един. Процесът на отделяне на частици от адсорбат от повърхността на адсорбента, т.е. явление, че обратното на адсорбция се нарича десорбция. Ако системата "адсорбат - адсорбента" при предварително определени условия, равни на скоростта на скоростта на адсорбция десорбция, състоянието на системата се нарича равновесие на адсорбция. Хемисорбция протича необратимо.
Количествено адсорбция на адсорбата изразено в молове на единица площ адсорбент (мол / m 2) или адсорбата в мола на единица тегло от абсорбираща (мол / г).
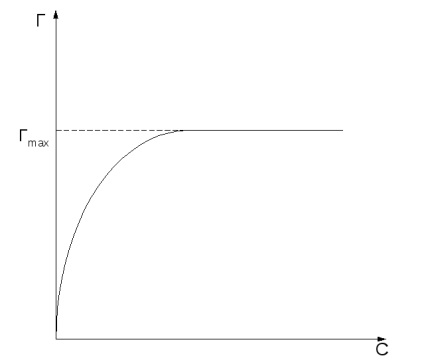
Количеството на адсорбция зависи от естеството на адсорбента и адсорбат концентрация и температура (или налягане) на адсорбат. Крива адсорбция стойност на равновесните концентрации на адсорбат или р налягане при постоянна температура Т се нарича адсорбционната изотерма: Т = F (в) или F = F (р) при Т = конст.
Зависимостта на адсорбция на концентрацията на адсорбент (Т = конст) се изразява с уравнението Langmuir (приемайки, че повърхността на адсорбента е хомогенна).
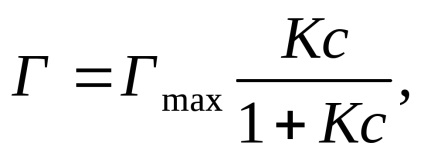
където Т е количеството на адсорбция; Gmax - максимален размер на адсорбция, причинени от повърхността на адсорбента; К - константа на равновесие на адсорбция; в - равновесна концентрация на адсорбента.
Адсорбционни увеличава с концентрацията или налягането на вещества, адсорбирани в съответствие адсорбционната изотерма (Фигура 2, а).
Изразяване на уравнението на Langmuir под формата:
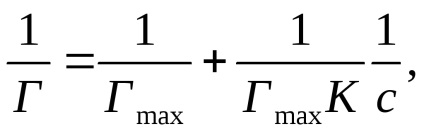
получена линейна зависимост на 1 / Т 1 / S (Фиг.2 б).
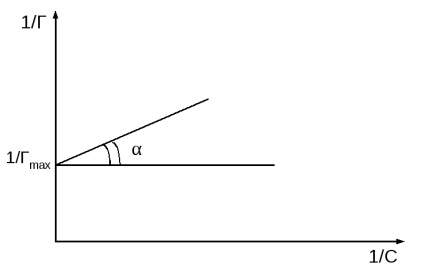
Фигура 2. Langmuir изотерма в две форми.
Пресичането на ордината на 1 / Gmax. и TG = 1 / K · Gmax
Графиката вграден координатите 1 / R - 1 / S, изчислена абсорбция максималната стойност (Gmax), а след това уравнение Langmuir равновесие на адсорбция константа (K).
При високи концентрации (налягане) стойност К · S "1
(К · р "1) Langmuir уравнение става F = Gmax.
Адсорбция се използва широко в морска, например, при пречистването на газове и течности от различните примеси; при обработката на морските технологии за лечение и подобряване на ефективността на смазочни материали, за решаване на екологичните проблеми във флота и т.н.
Свързани статии
