ГЛАВА 5 хибридомна технология. моноклонални антитела
В края на 60-те - началото на 70-те години на XX век. Разработени са лабораторни методи за клониране ин витро клетка. За тази цел, да създаде необходимата културална среда, материали за съдове и термостати инкубатори, които могат да симулират условията на вътрешната среда на организма да се запази жизнеспособността на клетки на бозайници. В рамките на 10-12 години, успя да клонира само туморните клетки поради способността им да притежават собственост е неограничен (по-благоприятни външни условия за тях) разделете на митозата. G. Keller и С. Milstein в 1974-1975 GG. Ние използвахме метода на производство на хибридни соматични клетки, които се използват за изследване на цитогенетичен локализация на гени, контролиращи дадена индикация в определена хромозома (хибридни клетки отделят повечето от хромозомите, но не всички), за лимфоцити, но за други цели. G. Keller и С. Milstein получили хибридните клетки от лимфоидни тумори (миелома) и нормални лимфоцити. Хибридните клетки са част от хромозомата (и следователно свойствата на) нормално лимфоцитите (от друга страна се изхвърля от хромозомите на клетките за първото деление генома все още не е стабилизиран) и част - на тумора. След като клетките се размножават наследени от миелома способността да се разделят за неопределено време. Същевременно те ходи биосинтеза на някои продукти от нормални лимфоцити, такива антитела; късно и изисква G. Keller и С. Milstein. Неограничен делящите се клетки "позволяват" сами да се клонира, т.е. физически "седни" за един (всеки в отделна купа) и получаване на клони на клетките - потомците на една клетка. Такива клетки се наричат хибридоми.
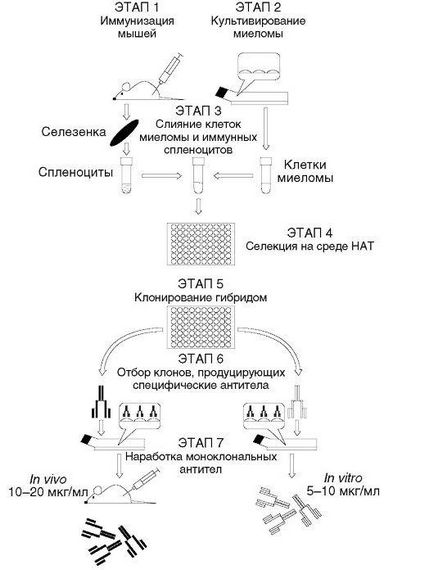
Лимфоцитите за хибридизация се получава от възли далак или лимфни предварително имунизирани с антиген на мишки (по-често - на линия Balb / C). Както тумор kletokpartnerov ползване специално отгледани за клетки, хибридома мутант миши миеломни (понякога наричан също плазмоцитом, че в този случай същите), получени от трансплантирани миеломна клетъчна линия МОРС-21 от Balb / C мишки
поддържани в култура ин витро до 1921 G. Keller и Milstein използване мутантни миеломни клетки, получени цитогенетични преди също за производство на хибридни клетки на бозайници, но за други цели: за хибридни клетки хвърлят повечето от хромозомата на останалите цитогенетични регулира локализация на определени гени priznakkodiruyuschih в определени хромозоми.
Суспензия на лимфоидни клетки от имунната мишките се смесват в една епруветка в минимален обем от среда със суспензия от миеломни клетки в продължение на 1-2 минути и се добавя слива агент. Keller и Milstein На първо място, това средство е както в cytogeneticists, Sendai вирус, но след няколко месеца имат всички "gibridomschiki" като слепващ агент, използван синтетични полимери, - полиетиленгликоли с молекулни тегла от 1540-6000 Г. След 1-2 мин клетъчна суспензия, съдържаща смес от некондензирани лимфоидни клетки, некондензиран миеломни хибридни клетки 3 варианти клетки ( "лимфоцитната-лимфоцит", "миелома миелом", "лимфоцит-миелом", на които се търсят клетки са само хибриди "лимфоцит-миелом"), промива и отгледани в изчисления обем на селективна среда HAT. NAT означава «Хипоксантин-аминоптерин тимидин». Тези 3 компонента се прилагат при известни концентрации в пълна хранителна среда. През първите 7-10 дни на културата, споменатата смес на клетки в култура, се случва следното:
1) некондензирани лимфоцити и хибриди "лимфоцит-лимфоцит" са убити поради тяхната естествена нестабилност;
2) некондензиран миеломни клетки и хибрид "миелома миелом" умират от неговата неспособност да извършва биосинтеза на ДНК в присъствието на аминоптерин - метаболитен отрова,
селективно блокиране биосинтетични ензими де ново пиримидинови бази N5 N10-метилен-тетрахидрофолат; биосинтезата на хипоксантин на пуринови бази в тези клетки е невъзможно поради липсата GGFRT; 3) само клетки, които са в състояние да оцелеят в HAT медии се желае, "лимфоцит-миелом" хибридни клетки: биосинтеза на пуринови бази са предоставили GGFRT ген, който е получен от нормални лимфоцити, и хипоксантин околната среда и биосинтезата на пиримидинови бази се извършва sredovye тимидин участие тимидин киназа. Основните етапи на хибридомна технология, са показани на фиг. 5.1. От клетка хибридни миелом данни клетки наследяват собственост на неограничен пролиферация. От нормални лимфоцити имунната Б - биосинтезата на имуноглобулини.
Разпространението на «нон-стоп» позволява да клонирате хибридните клетки, т.е. 1 в дисперсната добре и изчакайте една клетка от тази при благоприятни условия за растеж да растат клон т.е. много идентични клетки (с изключение на спонтанни мутации). Коя от получените "лимфоцит-миеломни" хибридни клетки произвеждат антитяло повдигнат, се установи, избор от ямките, съответстващи на проби от супернатанта имуноанализ. По-късно избран хибридом rekloniruyut и многократно изведен в масовата култура - реактори ин витро или асцитни тумори в сингенни мишки. От културални супернатанти или асцитни течности изолирани хибридом моноклонално антитяло в пречистена форма.
Ако клонинг на хибридни клетки синтезира антитела, тези антитела се наричат моноклонални. Опитът показва, че всички клонирани хибридомни клетки синтезират антитела същото - и специфичност на активното място и изотипа на тежката верига, т.е. Моноклонални антитела - не само моноклонинг продукт, но също така и подготовката на същите антитела. В края на 1970 сме култивирани ин витро и клонирани Т клетки не, кръстосани с туморна клетъчна линия. Това стана възможно само след откриването на фактор на растежа на Т-лимфоцити, по-късно наречени IL-2. Това клониране на Т-лимфоцитни субпопулации доведе до откриването на CD4 + Т-лимфоцити и да направи много други открития, включително идентификацията на HIV (достатъчно за изследване на броя на гени и протеини на вируса може да се окаже
само на Т лимфоцити, култивирани ин витро в присъствието на растежни фактори). В-лимфоцити, без да ги трансформира в хибридоми могат да бъдат направени да споделят (което им позволява да бъдат клонирани) когато заразяването им с Epstein-Barr вирус (го превръща нормални В-лимфоцити в тумора на В-лимфоцити).
По този начин, моноклоналните антитела, произведени от един клон са:
• високо специфични, като са насочени към дадена антигенна детерминанта;
• идентичен изотип, идиотип и алотип, както и афинитет и физико-химични характеристики.
Стабилни хибридни култури са способни да произвеждат неограничен брой моноклонални антитела.
Моноклонални антитела са широко използвани в различни области на медицината. Приложението моноклонално антитяло базирани в различни области е възможността за получаване на големи количества високо афинитетни антитела, специфични за:
1) до имуногенни антигени, хистосъвместимост и определяне диференциация;
2) диференциация, неопластични и други антигени на клетъчната повърхност, които са лишени от полиморфизъм и не-имуногенен в алогенни системи, но се разпознава, когато ксеногенна имунизация;
3) вирусни и бактериални антигени;
4) изолираните антигенни детерминанти на различни протеини, нуклеинови киселини и захари.
Използване на моноклонално антитяло позволява да се определи и да се отделят субпопулация на клетки, които отличават отделен етап клетъчно развитие, по-точно въведен тъкан по-точно идентифициране на микроорганизми, както и по-надеждно определяне на имунологични методи биологично важни макромолекулни.
голям брой системи за диагностика на различни заболявания, разработени в областта на медицината въз основа на Маб (инфекциозни заболявания, рак и др.). Активно разработени и лекарства на базата на Mab, например противоракови лекарства, анти-цитокинови антитела (лекарство remikeyt и др.) Въпреки това, е показано, че използването на миши моноклонални антитела за имунотерапия на неопластични заболявания води до различни странични ефекти и различни действия слаба ефективност.
Модификация миши моноклонално антитяло (хуманизирано антитяло конюгати на моноклонални антитела и високо -. Радионуклидите, лекарства, токсини, и т.н.) се отваря нови възможности в диагностиката и лечението на рак и други заболявания.
Свързани статии
