1. Получаване на соли
Органични киселини, за да образуват соли с метали, техните оксиди, карбонати, хидрогенкарбонати на алкални и, например:
CH3COOH + NaOH ® CH3COONa + H2O
2. Образование халогениди
Под действието на киселинни халогениди, карбоксилни анхидриди, фосфорен форма (хидрокси заместен с халоген):
CH3COOH + PCL5 ® CH3COCl + POCl3 + HCl
Киселинни хлориди могат да бъдат получени чрез действието на тионил хлорид на карбоксилна киселина:
CH3COOH + SOCl2 ® CH3COCl + SO2 + HCl
Карбоксилните киселини могат да бъдат възстановени само чрез използване на много силни редуциращи агенти, обаче първични алкохоли (вместо алдехиди) винаги са оформени като реакционни продукти:
CH3COOH + LiAlH4 ® CH3CH2OH
Карбоксилни киселини са много лесно губят въглероден диоксид. Обикновено се образува въглеводород. Алифатната карбоксилна киселина е декарбоксилирана в присъствието на различни катализатори, съдържащи мед. CH3CH2COOH ® CH3CH3 + СО2.
Това се отнася до реакция на декарбоксилиране и Колбе синтез (виж. Лекция №2).
В присъствието на силна киселина (например, сярна киселина) дава естери на карбоксилни киселини с алкохоли:
CH3COOH + CH3CH2OH «CH3COOCH2CH3 + H2O
Получената реакция произвежда равновесна смес. За да се измести равновесието към образуване на продукт, голям излишък от алкохол или вода се отстранява като се образува.
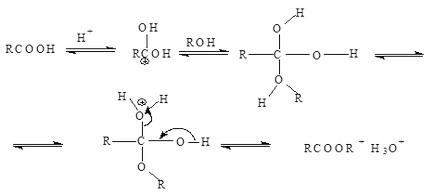
Механизмът на естерификация е присъединителна реакция - разцепване (нуклеофилно ацилно заместване) Протон катализатор, който улеснява атака на карбонилната група с нуклеофил:
Мравчена киселина. Получава се от неговата натриева сол (формиат), която се образува чрез преминаване на въглероден окис чрез 25-30% алкален разтвор:
NaOH + CO ® HCOONa
Суспензия на натриев формиат, след това се разлага мравчена киселина.
Мравчена киселина се използва за получаване на катализатори, в медицината и в някои синтези. е N, N-диметилформамид, HCON (CH3) 2 на най-голямата стойност от неговите производни. Той е селективен разтворител в разпределението на ацетилен газови смеси и абсорбция HCl, SO2, СО 2 и други газове.
Мравчена киселина има много химични свойства киселини, но са присъщи и на някои специфични функции:
1. е добър редуктор (лесно се окислява):
НСООН + HgCl2 ® Hg + СО2 + 2 HCl
Мравчена киселина намаляване свойства поради факта, че тя е в същото време е киселина хидроксиалдехиди и това е видно от формулата.
2. при загряване с концентрирана H2SO4 разлага до образуване на вода и СО:
3. соли на алкални метали разлагат при кондензиран до образуване на оксалатна сол (оксалат):
2 HCOONa ® H2 + NaOOC-COONa
Оцетна киселина. Той се използва широко за получаване на естери, оцетен анхидрид, винил ацетат, и в производството на бои, фармацевтични и ароматични вещества. Голямо практическо значение са соли на оцетна киселина - натриев, алуминий, хром, желязо, мед, олово и др В промишлеността оцетна киселина се получава по редица начини .:
1. окисление на алкани;
2. окисляването на етанол;
3. ацетилен хидратация и окисляване на получения ацеталдехид;
4. оцетна ферментация на захар-съдържащи разтвори.
