Досега нито една гледна точка на това на. всички йони и степента, в която участват в предаването на ток в електролитната получаването на алуминий. Повечето съветски учени се придържат към теорията PP Fedoteva разработен още през 2 години 1923-193. Последната работа от съветски учени (VP Mashovtsa, Г. Абрамов и др.) Го изясни. Според тази теория, разтопеното криолит. добре проводим това се дисоциира в йони:
Такъв характер дисоциация криолит и поддържа структура кристалната решетка (фиг. А) и в която оси лежат Нове октаедър с алуминиев йон в центъра и шест флуорни йони в ъглите. И тъй като се предполага, че течността в близост до точката на топене не е много различна структура от твърд орган, след това за топене криолит него трябва да се образуват "фрагменти" на своята решетка, т.е. йони 03 юни ALH .. -.
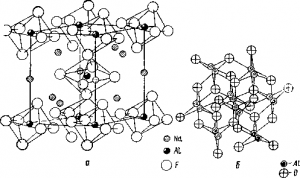
Фиг. Кристалната решетка криолит (а) и корунд (б)
Алуминий, се разтваря в стопен криолит, дисоциира в кислородни йони и алуминиеви йони, където PP Fedotiev смята, че най-вероятно е схема
Някои изследователи не споделят гледната точка на ПП Fedoteva на от характера на разпадането на алуминий в електролита. По този начин, VP Mashovets Предполага се, че кислородът е в електролита под формата на йони AlO2 -. VA Pazukhin вярваше - AlOF 4 йони 5 -. съществуващ заедно с О 2- йони. Чрез VM Guskov, AI Беляев и др. В криолит-двуалуминиев триокис-глинести форми земята стопени заедно с други йони O 2- йони и Al 3+.
Очевидно е, че механизмът на процеса на електролиза, за да бъде представена по следния начин. Криолит топи при близо до точката на топене се състои от йони Na + и ALF 3 6 - от
йонна връзка в кристалната решетка между натрий и флуор-слаба от тази между алуминий и флуор. Но това не изключва възможността за по-нататъшно разрушаване на кристалната решетка на Al 3+ йони и F -.
Тъй като кристалната решетка на двуалуминиев триокис се състои от йон Al 3+ и О 2- (фиг. В), след това разтваряне на двуалуминиев триокис в стопен криолит разлага на тези йони. Но е много вероятно, че йони кислород с малък размер и относително голям заряд, се свързват с други йони за образуване на някои сложни кислородни йони (AlO2 - или дори AlOF 4 5 -).
По този начин, течната алуминиева вана електролита, очевидно, състояща се от йон Al 3+. Na + F - и О 2. които са в непрекъснато движение и взаимодействие, могат да образуват комплексни йони ALF 3 6 -. AlO2 -. Възможна образование и други съоръжения. Всички тези йони са замесени в прехвърлянето на ток, въпреки че те споделят прехвърлянето не е еднакъв и се определя от тяхната концентрация и мобилност.
Изпуска електродите не са всички йони при прехвърлянето на ток, а само тези, със съответните стойности на потенциала на електрода. В катода с електрон-Olite криолит-алумина стопилки първо ще променлив освобождаване йон Al 3+. и анод йон О 2-.
Освободеният в анода реагира с кислород при анода където роден и образува газова смес от СО и СО2. Тези газове се развили на повърхността на анода се отделят в атмосферата. Където CO се изгаря за СО2. образуване на кора върху пламъците.
По този начин, процесът на електролиза е да се получи алуминий и разходите алуминиев оксид.
Аноден ефект електролиза на алумина стопилки
1%, за нормално работят електролитна клетка ефект анод се случи, то се появява външно, както следва: клетка напрежение (обикновено равно 4,1- 4,5) започва да се увеличава от няколко десети от волта листа, след това се увеличава рязко до 20-40 и в да контролира волтметър мига светлина. На повърхността на анода в контакт с електролит, се появяват електрически дъги, придружена с характерна шум. Електролитът се загрява бързо, увеличаване на изпаряване. Но това е достатъчно, за да се разтвори инча електролит нова партида алуминиев оксид като клетъчна напрежение се намалява ефектът на анод изчезва и възстановява нормалното протичане на електролизата.
В електролитната производството на алуминий анод ефект играе важна роля. От една страна, то улеснява услугата, Ана, сигнализация времето за зареждане на него, след като част от алуминий и дава индикация за това, което е нормално или ненормално работно баня. Ако ваната работи правилно, ефектът на анода се характеризира с внезапно токов удар се случва и на равни интервали, съответстващи на натоварени части в баня от алуминий и работна сила. Ако ефектът на анод се случва много късно или твърде рано и напрежението в клетката по време на анод ефект се издига леко или пулсиращ ( "мига" или "тъп" светкавица), баня работи ненормално и трябва много внимателно наблюдение и поддръжка.
От друга страна, наличието на анодни ефекти се отрази неблагоприятно на електролизата, което води до увеличаване на консумацията на енергия и флуориди аноди и усложнява постоянни електрически ток източници.
Ето защо, в алуминиев растения се опитват да имат минимален брой анодни ефекти, предотвратяване възникването им на не повече от веднъж на ден, в продължение на 2-4 минути. Разширено екип, ръководен електролиза. което позволява на анод ефект веднъж на 3-5 дни.
Аноден ефект е привлякъл вниманието на много изследователи и естеството на това, че има много различни гледни точки. Цялостно проучване на естеството на ефекта на анод се проведе в Московския институт на цветни метали и ги Gold. Калинин водена от chl.kor. AI Belyaeva с участието на BA Кузмин.
Резултатите от изследванията са довели до заключението, че ефектът на анод присъщ не само за електролиза крио-лито-двуалуминиев триоксид се стапя с въглеродните аноди (както е предложено от много чужди изследователи), но също така и характеристиката на електролитния процес в стопени соли с всички аноди. Ефектът на анод се случи, ако плътността на тока на анода става по-висока от решаващо значение.
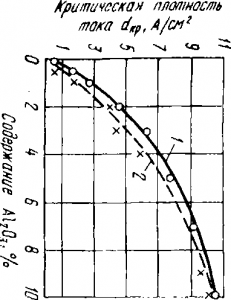
Фиг. 2. Промяна в критичната плътност на тока, като функция на съдържанието на алуминий в криолит-двуалуминиев триоксид се стапя:
1 - Според AI Беляев и Борис Кузмин; 2 - според Карп Ceva, дълг и Konchinskogo
Критичната плътност на тока, а оттам и на появата на ефекта на анод зависи от естеството на стопената сол, количествата на оксиди разтварят в стопена сол, анодната материала и температурата на стопена сол. Например, критичната плътност на тока на стопения хлоридна сол по-висока от флуориди. По-специално, силно влияе на критичната плътност на тока на стопената сол в присъствие на разтворени оксиди.
Фиг. 2 показва зависимостта на критичната плътност на тока в криолит-двуалуминиев триоксид се стапя съдържанието Al2 О3. От тази връзка, с увеличаване на съдържанието на Al2 О3 в стопилка криолит-алуминиев увеличава критичната плътност на тока и, следователно, намалява вероятността за възникване на анод ефект. Тъй като алуминиев баня работи при анод плътност на тока от 0,7 до 1,2 A / cm 2 в съответствие с графиката може да се заключи, че ефектът на анод трябва да става с намаляване на съдържанието на алуминий в електролита на
Въз основа на резултатите от изследователската работа на съветските учени, че е възможно да се въведе механизъм за анод ефект по следния начин: когато значителна част от алуминий
разтопен електролит мокри повърхността на анода и следователно премахва газовите мехурчета образувани. Чрез намаляване на концентрацията на разтворен алуминий в последния на електролита започва лошо мокро електрод, и когато стойността на ъгъла на контакт надвишава 90 °, вече не се намокри електрода. В резултат на това газът започва да живеят по повърхността на анода бързо покрита с резистентност газ филм на анода - електролит се увеличава постепенно. Само в рамките на няколко места, където филмът газ се разбиват временно, има краткосрочни електрическа дъга. Когато се прилага в новата част от електролита на електролита алуминиев на мокро анода започва отново, бързо премахва газ от повърхността на филма и клетъчно напрежение се намалява.
Средни процеси на катода и електролита
В електролитен метод за производството на алуминий, освен посочените по-горе основни процеси се появят някои странични процеси, които могат да доведат до загуба на метал, D увеличаване консумацията на енергия, влошаване на качеството на метала, промяна на състава на електролита и така нататък..; най-важните от тях: разтварянето на алуминий, образуване на алуминиев карбид, импрегниране лигавицата електролит баня.
Разтварянето на алуминиев оксид в електролита
Металът алуминий се разтваря в течния електролит малко (около 0.1%). Въпреки това, чрез разпръскване на електролита, алуминий се окислява на повърхността им от атмосферен кислород, но също реагира с анод газ за образуване Al2 О3 и причинявайки по този начин разтваряне на нови порции на метала в електролит. Разтворимост на алуминий в електролит и следователно метал окисляването нараства силно с увеличаване анод-катод разстояние и с повишаване на температурата. Във връзка с този процес са склонни да доведе при температура възможно най-ниски, но не прекомерно намаляване на interpolar далечината.
Образуването на алуминиев карбид
Когато прегряване баня алуминиев започва да реагира с въглерод, попадащи в електролита да се образува алуминиев карбид:
Благоприятни условия за образуване на карбид са създадени в случай на алуминиевия слой е изложено по въглища
огнище или стената на вана (латерална натрупване поради топене). След това директно върху повърхността на въглищата разредена алуминиеви йони и алуминиеви атоми, взаимодейства с въглеродния атом, за да се образува карбид. Tugoplavok алуминиев карбид, има по-висока плътност и ниска електрическа проводимост; се формира на огнището баня под алуминиевия слой, както и в тегло на електролита, създаване на допълнителна устойчивост. Алуминий може да реагира с въглеродния атом, прониква в порите и пукнатини въглероден лигавица, като се образува светло жълти кристали от карбид.
Промяна на състава на електролита
Електролитът в резервоара с течение на времето, промяна на структурата си, и не винаги едни и същи. Наблюденията показват, че в първите месеци на нова баня работи електролит губи значително количество натриев флуорид и се превръща в кисела. В старите бани, състоящо се от повече от една година, точно обратното е вярно - електролит алуминиев флуорид губи и става алкална.
Изследване на процесите на омокрящи флуоридни соли въглеродсъдържащи материали, проведено в Института на цветни метали и ги Gold. Калинин AI Беляев и сътр. Това показа, че натриев флуорид мокри въглеродния материал е значително по-добре от алуминиев флуорид или криолит.
Следователно, натриев флуорид. което може да се появи в електролита в резултат на дисоциация на криолит се абсорбира главно в порите на въглероден катод блокове и отново да загуби ваната, като по този начин се нарушава криолит съотношение на електролита-вой. Проучвания дънни блокове на старите, западнал електролитни вани потвърждават този извод. Плътност блокове по време на работа баня увеличава времето на спиране баня и половина пъти, продуктът се абсорбира блокове съдържа 70-75% NaF; 5 -7% AlF3; до 20% Al2 О3. както и определено количество AL4 C3 и метален натрий.
Селективно абсорбция на въглероден облицовка на натриев флуорид, значително в първите месеци на банята поради запълване на порите, постепенно намалява и след няколко месеца е напълно спрян.
алуминиев флуорид загуба от електролита може да се дължи на изпаряването на някои от това вещество. особено по време на анодни ефекти поради еластичността AlF3 пари при температурата на процеса е около 1 кРа.
Заедно с изпаряване на алуминиев флуорид в електролита взаимодейства с примеси криолит (SiO2. Na2 О, Н 2О), попадащи в баня заедно с алуминий и флуоридни соли. Na2 О, оставащо в алуминия поради недостатъчно промиване хидрат криолит разлага съгласно реакцията:
SiO 2. получаване в банята като смес от алуминий и криолит разлага частично, замърсяване на силиций, алуминий, и частично но взаимодейства с криолит чрез взаимодействие на
образуване на летлив силициев тетрафлуорид и разрушаване комплекси йони и алуминиев флуорид (ALF 3 6 - и т.н.).
При нормална услуга баня в нея се въвежда само предварително затоплена добри продукти. Следователно, водна пара може да се получи в стопен електролита в присъствието само на определено количество алуминий в хидрат алуминиев оксид. В тези случаи, реакцията не е изключено
Всички тези реакции водят до излишък от натриев флуорид в електролита.
