Получаване на първичната структура на протеинови хормони или прохормони-пептид първоначално - пряк резултат от транслацията на нуклеотидни последователности на съответната иРНК синтезира от активни региони на генома на хормон-продуциращи клетки. Структурата на повечето хормони или техните протеинови прекурсори образува полизоми в общата схема на протеин биосинтеза (фиг. 26).
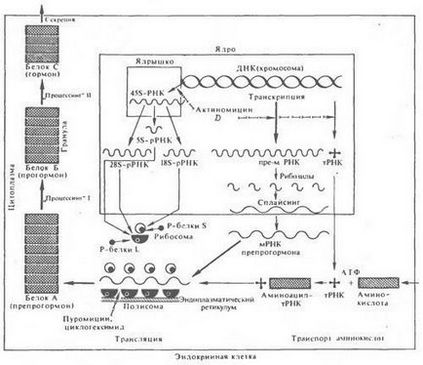
Фиг. 26. синтеза на протеин в животинска клетка
Синтезиран протеин полизоми клетки ендокринни жлези - най-често krupnomolekulyarnyh прекурсорен пептид хормон (preprohormone)
По този начин възможността за синтеза на иРНК и транслация на този хормон или неговите прекурсори, специфично за ядрената апарати и полизоми тип специално клетка. По този начин, инсулин и неговите прекурсори се произвеждат по-специално в клетките на Лангерхансовите островчета на панкреаса, глюкагон - в техните и-клетки, растежен хормон - в малък еозинофили предната хипофиза пролактин - в големи еозинофилни клетки на същия рак и гонадотропин - в специфични базофилни клетки и и т.н.
Изключение от общото правило биогенезата пътища на хормон на биосинтезата на полипептиди такива освобождаващи фактори в клетки на хипоталамуса, TRF както и LH-RH. Синтез на тези малки пептиди не може да се появи в полизоми в матрицата иРНК и разтворимата част от цитоплазмата под влиянието на специален за всеки фактор RF синтетаза системи, състоящи се от набор от специфични ензими (Rayklin сътр 1972, 1973 ;. Johansson сътр 1973).
А живеят уебкаст на генетичен материал в синтеза на повечето полипептидни хормони често води до образуването на хормона себе си не е, и неговите неактивни прекурсори - preprohormone полипептидни (pregormony).
В такива случаи, биосинтезата на полипептиден хормон се състои от два етапа: 1) рибозомна синтезата на неактивен прекурсор RNA шаблон и 2) пост-транслационна образуване на активния хормон. Първият етап се появява необходимост в клетки на жлезите с вътрешна секреция, а вторият - се извършва обикновено в жлезите с вътрешна секреция, но може да се появи навън.
Пост-транслационни активиране на хормон прекурсори (обработка на протеини) може да се осъществи в две форми: от множество молекули разграждане ензимни излъчват krupnomolekulyarnyh прекурсори с намаляване размера на молекулата (или молекули) активируем хормон (или хормони) и поради неензимни асоциация progormonalnyh субединици размери разширяване активируем хормон молекула , Тези пътища на образование не са уникални за хормони, но също така и за други секретирани протеини (Neurath, 1977).
Първата форма на посттранслационна активиране се появява най-често като процес на няколко стъпки, изпълнени с участието на специфични протеази ограничено действие. В резултат на това на излъчването при пряк генетичен контрол, в такива случаи krupnomolekulyarnyh, краткотрайно предшественик preprohormone. Това е обикновено хидрофобен N-край и лесно прониква през мембраната на ендоплазмения ретикулум, които са свързани с неговите ансамбли синтезиращи полизоми.
При преминаване през ретикулум на мембрана се осъществява чрез ензимно разцепване pregormona хидрофобна част с N-края на молекулата и в резервоарите образуват ретикулум пресечен молекула повече хидрофилни и прохормон. Прохормон движи от течната част на цитоплазма (цитозол) в секреторния гранула, или секретира в кръвта като така наречените "големи" хормони. Кръвта открива, по-специално, "голям" инсулин "голям" растежен хормон "голям" РТН т.н. (Yalow, 1978, 1979).
Гранулите на ендокринни клетки или извън прохормон разгражда активирани и става истински хормон. Обаче, активната хормон може на свой ред да бъде прохормон за други хормонални съединения и се превръща в него под действието на протеази периферните тъкани. Схема процес в общ вид, както следва:
Схема на биосинтеза на протеин-пептидни хормони
Протеази ограничени действия, извършени медиирани генетичен контрол на биосинтеза на хормони този тип.
Втората форма на пост-транслационна активиране обикновено се извършва в ендокринни клетки и характеристика на димерни гликопротеинови хормони. Движеща сила на този процес е както следва:
Втората форма на пост-транслационна активиране
Поставяне въглехидратни остатъци на субединицата е ензимен процес. Освен това, всяко подразделение може да бъде отцепена ензимно от prosubedinitsy.
Първата форма на активирани прекурсори на пептидни хормони са добре проучени за биосинтезата на инсулин, паратироиден хормон, ангиотензин, в lipotropina, АСТН, и редица други протеинови и пептидни хормони. Да разгледаме пример на процесите в биогенезата на инсулин в панкреаса на островни клетки апарат (Steiner и сътр. 1969, 1976). В първия етап на синтеза на хормон в клетката полизоми късо синтезира пептид с единична верига, състояща се от аминокиселинни остатъци 104-110, с Mw-11500.
Този кратък живот протеин, не притежава биологични aktivnos / ю, той е обявен за препроинсулин или preinsulinom. В него край / N-верига е хидрофобен сигнален пептид 23-членен свързва с а-веригата на бъдещата инсулин (30 остатъка) към С-края е А-tssp инсулин (21 остатъка) и между В и вериги Това е вмъкната пептид (30-35 остатъци в различни видове) (фиг. 27). Сигнални пептиди са променливи и вмъкнати в различни животински видове. Резервоарите груб ретикулум по пътя от полизоми в препроинсулин секреторни гранули първо се подлага на протеолиза с N-края, при което разцепва сигнален пептид от 23-членен, "влачи" pregormon през мембраната.
В резултат на препроинсулин, проинсулин се превръща в - едноверижен полипептид, който се състои от аминокиселинни остатъци 81-86 (ММ - 9500) и има ниска биологична активност. Секреторната гранули настъпва превръщане на проинсулин в инсулин чрез ензимно ексцизия клин пептид. Този процес се извършва на два етапа, с участието на две групи ензими: специфичен трипсин-подобни ендопептидаза (конвертиращ ензим) причинява сайтове на разцепване Apr-Apr и Lys-Apr; karboksipeptidazopodobnyh ензими (карбоксипептидази В) разцепват 3 април 1, и Lys.
В резултат на тези ензими се образува двуверижна активна форма на инсулин (51 аминокиселинни остатъци, ММ - 5700), свързваща молекула или С-пептид (26-31 остатък в различни видове). 3 молекула една молекула на аргинин и лизин. РЕЗЮМЕ активиране механизъм в този случай се намалява до изрязване на проинсулин молекула клин пептид, който осигурява необходимата за проява на висока биологична активност взаимно пространствено ориентиране на веригите А и Б свързани чрез два дисулфидни моста.
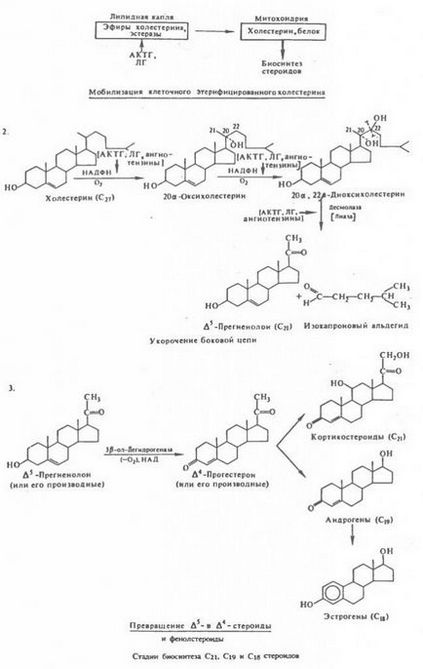
Етап биосинтеза С21, С19 и С18 стероиди
Описаните принцип активиране протеин-пептидни хормони в тяхната биосинтеза изглежда е универсален, но могат да варират в молекули подробно прекурсори и влошаване на характеристиките на етапите на метода тъкан локализация. По този начин, едноверижен пептид - паратироиден - (. 1974 Kemper и др, 1976), оформена в клетките на паращитовидните жлези чрез последователно разграждане на неговите krupnomolekulyarnyh прекурсори с N-края на молекулата. Полизомите preproparatgormon първоначално синтезирани, съставен от 115 аминокиселинни остатъци. След отцепване на N-терминалната част на 25-членен pregormona хидрофобна част, образувана паратироиден хормон (90 аминокиселинни остатъци). От прохормон в секреторни гранули клетки паращитовидната жлеза, образувани след разцепване на 6-членен N-фрагмент от молекула край progormonalnoy.
От preatriopeptida (аминокиселинен остатък 151) е оформен в миокарда първия proatriopeptid Получената разцепване с N-края на 25-членен сигнализация част. От последните след това се разцепва ANF (остатъци 124-151 в pregormone) и kardiodillatin (остатъци 26-92 в заготовката).
Свързани статии
