По атомно-кристална структура разбере взаимното разположение на атоми (йони), съществуващи в реално кристал.
В състояние метал твърдо вещество е конструкция, състояща се от положително заредени йони, промива се с "газ" достъпно от пътуващи електрони. Комуникация в метала се извършва от електростатични сили. Между йони и електрони възникне пътуващи проводимост електростатичните сили на привличане, които стягат йони. Такава връзка се нарича метал.
Свързващите сили в метали се определят от сили на отблъскване и сили на привличане между йони и електрони. Атомите (йони) са разположени на такова разстояние един от друг, при което енергията на взаимодействие е минимална.
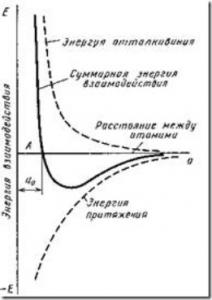
Фиг. 4. Схема на енергията на взаимодействие между два атома, като функция на разстоянието interatomic
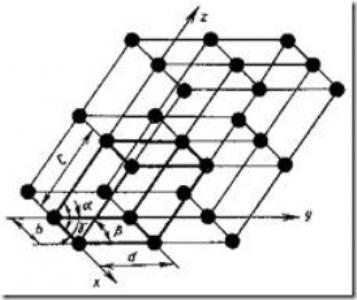
Фиг. 5. Диаграма на кристалната решетка
Както се вижда от фиг. 4, тази позиция съответства A0 равновесната разстояние. Сближаване атоми (йони) на разстояние по-малко от a0, или ги премахва от разстояние от около a0, възможно само при извършване на определена работа срещу силите на отблъскване и привличане.
Следователно, метални атоми са разположени редовно, за да се образува редовен кристална решетка, която отговаря на минимални енергийни взаимодействие атоми.
кристалната решетка
Кристалната решетка (фиг. 5) се състои от въображаеми линии и равнини, минаващи през подреждането йон на точки в пространството. Bold линии, получени малкият паралелепипед последователно движение от които по трите оси на целия кристал може да бъде построена.
Най-малкият обем на кристала, което дава представа за атомна структура на метала във всяко количество, дадено името на единица клетка на кристала.
За своите уникални характеристики трябва да бъдат известни следните стойности: три ръбове (А, В и С) и три ъглите между осите.
Повечето метали образуват една от следните високо симетрия решетки с плътна опаковка атоми: тяло центрирана кубична, лице центрирана кубична и шестоъгълна (фигура 6).
Както се вижда от фиг. 6, и в тялото центрирана кубична решетка (Ск) атомите, разположени във върховете на куб и друг атом в центъра на обема на куб. Телесна-центриран куб решетка са метали: Pb, K, Na, Li, Ti, Zr, ТА, W, V, Fe, Cr, Nb, Ba, и др.
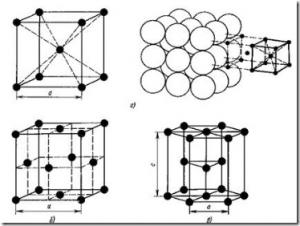
Фиг. 6. метална решетка: и - тяло центрирана кубична (Ск); б - лице центрирана кубична (FCC); в - шестоъгълна плътно опаковани (НСР)
лице центрирана решетка
лице центрирана кубична решетка (FCC) атоми са разположени в ъглите на един куб и центъра на всяка страна (фиг. 6Ь).
В шестоъгълна решетка (Фигура 6, с.) Атомите, разположени във върховете и центъра на шестоъгълна призма бази и три атоми - в средната равнина на призмата.
Разстоянията А, В, С между центровете на съседни атоми в единичната клетка се наричат периоди решетка. В решетка период се изразява в нанометри (1 пМ = 10-9 cm).
решетка периоди за повечето метали е в рамките на 0.1-0.7 пМ.
В една единица клетка на тялото центрирана решетка попадат два атома, един в центъра на куба и са въведени други атоми, които са разположени в върховете на куба (горната част на всеки атом в куба едновременно принадлежи осем двойки единични клетки и тази клетка има тегло на 1/8 от атом, и цялата клетка 8 1/8 X = 1 атом).
На лице центрирана кубична единица клетка на решетката попада четири атома; една от тях (според същия изчисляване като за кубичен решетка тялото центриран) атоми са въведени в върховете на куба, и по-общо три ((1/2) X 6 = 3) да атома, разположени в средата на ръба, като всеки от тях атома, принадлежащи на две решетки.
Фиг. 7. диаграма, показваща броя на атомите, равни и най-близо до атом присъства в различни кристални решетки (SS Steinberg): и - К8; б - К12; в - G12
В единичната клетка от шестоъгълни близки опаковани решетъчни атоми попадат шест (3 + (1/6) X 12 + (1/2) х 2 = 6).
решетка плътност - обем заета от атоми, които могат да бъдат грубо считат твърди топки, характеризиращ координация номер, чрез който се разбира броят на атомите в равен и най-малкото разстояние от даден атом. Колкото по-висока координация брой, по-голяма от плътността опаковане на атомите.
единица клетка на кубичен решетка тяло в центъра на, най-късото разстояние между атомите, съответстваща г = 0,5 А \ / 3. След това разстояние 8 съседи са от този атом (Фиг. 7а). Следователно, броят на координация за BCC съответства 8 и определен К8. Коефициент компактност клетка, определен като съотношението между обема заета от атомите, към обеми клетки до 68% от БКК.
За кубичен координация решетка брой лице центрирано е 12 (К12); всеки атом има 12-близките съседи на разстояние D = 0.5 А \ / 2 (фиг. 7Ь), което съответства на максималната плътност опаковане или опаковане под формата на топки. В шестоъгълна решетка близо опаковани, за които а / а = 1,633, има координация брой 12 (G12), който също отговаря на максимална плътност на опаковане сфери (атоми) (фиг. 7с). Много метали, които кристализират в шестоъгълна система, съотношение С / А е в диапазона 1.57 - 1.64 .., т.е., може да се отклонява от най-близкото опаковка, където в / а = 1.633. Ако съотношение С / А е от 1,633 значително различно (например, цинк и кадмий), координация номер 6 съответства на шестоъгълна решетка.
Лице центрирана кубична и шестоъгълна плътно опаковани (с / а = 1.633) на решетката - най-компактен; там фактор компактност е 74%.
При намаляване на броя на координация в шестоъгълна решетка с 12-6 коефициент компактност е около 50%, и с координация номер 4 - около 25%.
Половината от най-късото разстояние между атоми в кристалната им решетка наречен атомен радиус. Атомното радиус увеличава с намаляване на броя на координация, тъй като това увеличава пространството между атомите. Следователно, атомната радиусите на различни метали обикновено се дава на К12.
Още по темата
