Запознаят с апарат предприятието накратко молекули, т.е.. Е. частици в които комбинират няколко атома. Съществуват два начина за образуване на молекули от атомите.
Първият от тези методи се основава на наличието на неутрален атом е електрически заредени частици. Ние вече посочи, че атом е неутрална, т.е.. Е. Броят на положителните заряди в ядрото (брой протони) е базирана на броя на отрицателни заряди ,. Е. броя на електроните орбита ядрата.
Ако по някаква причина атом губи един или повече електрони, в основата си е известен излишък на положителни заряди не са базирана отрицателно заредени електрони, и така атом става положително заредени частици.
Тези електрически заредени частици са наречени йони. Те насърчаване на образуването на молекули от атомите.
Изследване на свойствата на различни химични елементи показва, че във всички случаи най-стабилните тези, в които външната електрон орбита напълно пълен или съдържа най-стабилната броя на електроните - 8.
Това потвърждава отлична периодичната таблица, където нула групата, разположен най-инертен (т. Е. стабилен и не реагират химически с други вещества) елементи.
Това е, на първо място, хелий, който има един орбита запълнена с два електрона и газове неон, аргон, криптон, ксенон и радон, който има осем електрони в най-отдалечените орбита.
Обратно, ако външната орбита атома има само един или два електрона, тези атоми са склонни да даде тези електрони на друг атом, при който в най-външния орбита на електрон липсва 1-2 до номер осем. Тези атоми са най-активни да реагират един с друг.
Вземете например молекула на сол. наречен по химия и натриев хлорид, образуван като показва името му, на натриеви и хлорни атоми. В натриев атом има един електрон във външна орбита, докато хлорен атом, - седем електрони.
Ако тези два атома са близо един до друг, един електрон натрий, разположен на най-външния орбита и слабо "прикрепен" си атом, могат да се откъснат и да се премести на хлор, което ще бъде осмото електрон във външната орбита (фиг. 4 както и).
В резултат, такъв преход са оформени две йони: (. Фигура 4Ь) положителни натриеви йони и отрицателен хлорен йон са привлечени един към друг и се образува молекула на натриев хлорид, който може да бъде представен като две топки, затегнат с пружина (Фигура 4 инча) ,
Вторият метод за образуване на молекули от атомите, се състои във факта, че подходът на две или повече от тези атоми са атомите в външните електрони орбита се преподреждат, така че те се свързват с два или повече атома. Електроните, които са на вътрешните орбитите останат свързани само с атома.
В този случай, отново, е налице тенденция да се образува най-стабилните орбитите на електроните осем.
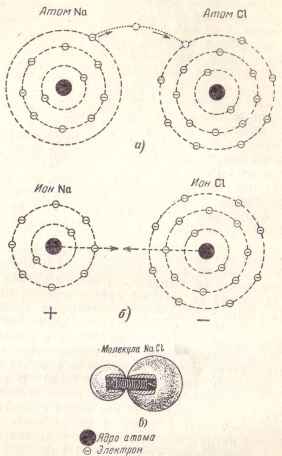
Фиг. 4. Схема на молекулата на натриев хлорид.
Даваме няколко примери на такива молекули.
Да разгледаме молекула на въглероден диоксид, състояща се от въглероден атом и два кислородни атома. При образуването на тази молекула след настъпва Rebuild външни електронни орбити на атомите (Фигура 5)
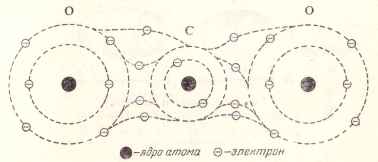
Фиг. 5. Диаграма на молекули въглероден диоксид.
въглеродни резерви, свързани с ядрото на два електрона от вътрешната страна на орбитата, и четири електрони, които са на външната орбита, разделени от два електрона на кислороден атом, който от своя страна се дава на всеки от два електрона за общо комуникационни въглеродни атома.
По този начин, всеки въглерод-кислород връзка взаимно участват две двойки електрони, при което всеки от трите атоми на такава молекула има стабилна външния орбита на която осем електрони въртят.
Има, както е известно, молекулите не само образувани от различни елементи, но същите атоми.
Образуването на тези молекули също се дължи на желанието за по-устойчива осем пъти броя на електроните в картонената орбита.
Например, кислороден атом, като два електрона на вътрешния орбита и шест електрони във външната орбита липсва два електрона за образуване осемкратно среда.
Следователно, тези два атома са свързани за образуване на молекула кислород O2. където два електрона от всеки атом са обобщени, след това около външната орбита ще се завърти осем електрони.
При образуването на молекули на втория метод, когато обмен на електрони между атомите, центровете на атоми, необходими да се подходи по-различен от първия метод, когато има само взаимното привличане на противоположно заредени йони.
Ето защо, ако първият метод можем да си представим такава молекула под формата на две съседни топки йони (фиг. 4с), които не променят техния размер и форма, след това вторият метод, сферични атома като сплескан.
Съвременни методи за изследване на структурата на вещества могат не само да знаят, от която различни молекули се състоят от атоми, но атома подредени в молекули, т.е.. Е. структурата на тези молекули е до разстоянието между ядрата на атомите, включени в молекулите.
Фиг. 6 показва структурата на молекулите на кислород и въглероден диоксид, както и местоположението на ядрата на атомите в тези молекули, показващи interatomic разстояния в ангстрьома.
кислород молекула се състои от два атома, е под формата на две топки компресирани с разстоянието между ядра 1,20A атома. молекула въглероден диоксид, състояща се от три атома, с права форма с въглеродния атом в средата и от двете страни на това в права линия два кислородни атоми с internuclear разстояние от 1,15 А.
Фиг. 6. Състави на молекули: а - разположението на атомите; б - местоположението на ядрата на атомите; 1 - O2 молекула кислород; 2 - въглерод молекула СО2 диоксид.
Свързани статии
