Цели. За въвеждане на позицията на желязо в периодичната система на химичните елементи Менделеев, атомната структура, природни залежи, съединения с модерни методи на получаване, свойства и употреба на желязото. Насърчаване развитието на екипни умения на студентите и другарска взаимопомощ.
Оборудване и реагенти. Тръби за маса производство доменна пещ; разтвор на солна киселина и H 2SO 4. прахове от Fe (ОН) 2 и Fe (ОН) 3. железни стружки, разтвори фероцианид сол К4 [Fe (CN) 6], и червени кръвни соли K3 [Fe (CN) 6].
Вид на урока. Елементи на лекции, история, разговор.

- магнетит Fe3 O4- съдържа 72% желязо, магнетит отлагания се намират в магнитна аномалия Южна Урал Kursk;

Регенерация се провежда при температура от 850-900 ° С, което е под точката на топене на желязо (1539 ° С).
В продължение на много модерни машини сектори изискват много висока чистота желязо. След пречистването се провежда метод технически желязо карбонил. Карбонили - метално съединение с въглероден монооксид (II) съвместно. Желязо реагира с СО при повишено налягане и температура 100-200 ° С, образувайки желязо ПЕНТАКАРБОНИЛ:
Желязо ПЕНТАКАРБОНИЛ - течност, която лесно може да се отдели от примесите чрез дестилация. При температура около 250 ° С карбонил разлага лесно да образува железен прах:
Когато Полученият прах се подлага на синтероване във вакуум, полученият метал, съдържащ 99,98-99,999% желязо. Защо е необходимо да се получи метална чистота?
Student. високо желязо чистота трябва на първо място да учи неговите свойства, т.е. за научни цели. Ако не може да се получи чисто желязо, може би не знаят, че е - мека, лесна за използване метал. Химически чиста желязо е много по-инертен от поддръжка желязо. Важен сектор е използването на чисто желязо производство специално феросплави, имоти развалят от присъствието на примеси.
Учител. Какви са химични свойства на желязото?
Student. Химичните свойства на желязо поради структурата на електронен слой на неговите атоми. Желязо - елемент на преход група VIII на дълъг период на четвъртата група. Желязо се отнася до D-елементи, атоми формула Е е краят ... 3d 6 4s 2. железни съединения в окислено състояние експонати +2 и +3. Максималната степен на 6 окисление на желязо. Това се проявява в Ferrata - железни соли несъществуващ киселина. Например, Na2 FeO4- натриев ферат.
Учител. Тъй като желязото реагира с кислород?
Student. В електрохимична серия напрежения желязо е останало от водород, т. Е. има по-отрицателен потенциал стандартен електрод. Следователно, желязо лесно се разтваря в разредена солна или сярна киселина с отделяне на водород:
Повече концентрирана сярна киселина (40-60%) до железни възстановява
серен оксид (IV):
Сярната киселина има по-висока концентрация (80 до 100%) zhelezopassiviruetsya - и покрити с тънък твърд оксид филм, който защитава от метал се разтваря. Същото явление на пасивиране среща в силно концентрирана азотна киселина, така концентрирана сярна и азотна киселина може да се транспортира в контейнер желязо.
С разредена азотна киселина може да реагира с желязо до образуване на сол на желязо (II), но с по-концентриран разтвор на киселина - сол на желязо (III) киселина и различни продукти за възстановяване, например:
Учител. Не забравяйте, че това, което се нарича корозия. Какви са неговите ефекти?
Student. Корозия - за унищожаване на метала под действието на околната среда. Rust могат да бъдат представени, както следва:
Rust обелени от металната повърхност има много пори, така че не предпазва метала от по-нататъшно корозия. Поради корозията умира огромни количества желязо и неговите сплави. В XIX век. когато не е имало надеждни методи за контрол на корозията, от загива половината от разтопен метал. В съвременните условия на корозия умира 1/6 от разтопен чугун. Ето защо, контрол на корозията - един от най-големите проблеми на човечеството.
Учител. Дали амфотерни съединения на желязо?
(На въпрос може да се отговори на себе си или на предварително подготвени с интерес към студент по химия учител.)
.. Iron хидроксид (III) amfoteren, т.е. проявява свойства на база в реакцията с киселина:
и киселинни свойства в реакции с концентрирани разтвори на основи:
Амфотерно характер и има железен оксид (III), който реагира с киселини и основни оксиди:
Учителят се фокусира върху студентите, че са налице типични реакции към съединения на двувалентни и тривалентни желязо, придружаващи си история провеждане на експерименти.
Учител. За откриване на йони на желязо (III) комплекс съединение е удобно да се прилага желязо наречен фероцианид сол или хексацианоферат (II) К4 калиев [Fe (CN) 6]. Чрез взаимодействие йони (Fe (CN) 6) 4- до Fe 3+ йони, образувани тъмносин утайка - пруско синьо:
Други желязо съединение - червени кръвни сол или хексацианоферат (III) K3 Калиев [Fe (CN) 6] е реагент йони Fe 2+ на.
Чрез взаимодействие на йони (Fe (CN) 6) 3- с Fe2 + йони също произвежда тъмносин утайка - turnbuleva Blue:
Избройте основните приложения на желязо. Важното е естествената желязо?
(Учениците отговарят на въпросите, учителят обяснява техните отговори.)
Първият ученика. Ferrates различни метали се използват в съвременните електронни индустрии и автоматизация.
Вторият ученика. Необичайни образува съединение с желязо, водород, азот и въглероден. Атомите на тези неметали са оразмерени по-малко желязо атоми и са лесно включени между металната решетка на възли, образувайки твърди разтвори.
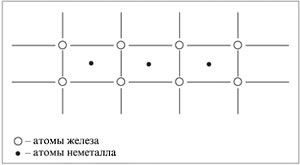
Следващите въпроси са предназначени за студенти, за консолидиране на материала учи.
1. Какво е състоянието на желязото в периодичната таблица на химичните елементи?
2. Какво е степента на окисление на желязото в проявяват съединения?
3. което железни съединения имат амфотерни свойства?
4. желязото реагира с азотна киселина и сярна киселина на различни концентрации?
5. Как да се направи разграничение между съединения и на желязо?
6. Какво е използването и стойността на железни съединения на настоящия етап от развитието?
Ако времето позволява, можете да поправите разглеждания материал за желязо, използва следните въпроси.
1. Какви са предимствата на прекия метод за производство на желязо?
2. Защо се използва руда обогатяване?
3. Как да обогатят рудата чрез флотация?
4. Каква е основната смисъла на желязо метод техническа почистване карбонилна?
СПРАВКА
N.I.TKACHENKO,
химията и биологията учител
(Уст Джегута,
Карачаево-черкези република)
Свързани статии
