Катионни инициатор на полимеризацията е източник на положително заредени частици, които възникват или спонтанно или в резултат на взаимодействие с мономера или специално прилаганото съединение. Обикновено инициатори са киселинни вещества: апротонни и протонни киселини, Люисови киселини комплекси със съединения - донори на електрони на въглеродни тип сол Ph3 C + · SbCl6. оксониева сол Et3 О + · SbCl6
Люисова киселина - AlCl3. BF3. SnCl4. ZnCl2. TiCl4 и т.н. -. Използва се за ниска температура катионна полимеризация на алкени води до образуване на полимери с високо молекулно тегло. Тези киселини са като цяло използвани в комбинация с протонен донор или други добавки.
Таблица 1. Някои катионни полимеризационни инициатори алкени
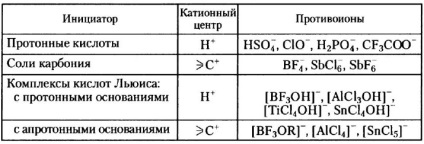
Протонни киселини за образуване на полимеризацията на катионен се използват само ако те не са анион, образуван има силен нуклеофилност; в противен случай тя образува с протониран мономер ковалентна връзка:
Поради високите nuklefoilnosti халогените, халогеноводородни киселини, които не се използват като инициатори на катионна полимеризация. За полимеризация на някои мономери (например, по-високи ненаситени въглеводороди, кумарон, инденови) използват фосфорна киселина, сярна киселина и перхлорна киселина, и въпреки че обикновено се получава олигомери.
Например, изобутилен не е чувствителен към сух BF3. но полимеризира незабавно прибавяне на малки количества вода; активатор (вода) взаимодейства с инициатор за образуване на комплекс, който протонизиране мономер и допълнително генерира започване на растежа верига видове катионни:
В стъпка на започване на протонната свързана към молекула мономер и образува йонна двойка
След това йонна двойка взаимодейства със следващата мономер молекулата:
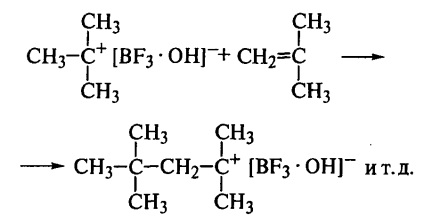
По този начин, в края на нарастващата верига винаги е carbocation с counteranion. Благодарение на поляризацията на молекулата на мономер е предоставена редовно се присъединят единици "главата до опашката" от типа, като различен тип връзка това е просто невъзможно. Следователно, полимерната верига е химически редовен структура. ниска диелектрична константа среда (хлорирани въглеводороди) допринася за поддържане на йонна двойка във веригата.
Като цяло, процесът на започване катионна полимеризация в присъствието на киселина на Люис и добавки могат да бъдат представени схеми:
По отношение на тези активатори, като алкил халиди, например в системата:
иницииране на формирането на катионни разновидности е възможно само с участието на мономер:
По същество само един възможен катализа на Люисова киселина, когато тя е способна да образува йонна двойка:
Освен по-горе, като инициатори на катионна полимеризация, използвайте I2. Cu 2+. както и високо енергийно лъчение. Каталитичното действие на йод основава на следните реализации:
По този начин, HI изпълнява функция активатор във връзка с I2. Си2 + йони инициира полимеризацията или чрез окисление на пи-електрон връзки (преход от мономер на Си2 +), или чрез поставяне на я-връзки.
Карбониев соли за възможен механизъм започване състоящи се в електронен трансфер от мономера на катион за образуване на свободни радикали и мономер радикал катион:
свободните радикали, генерирани от тази схема са много стабилни и като изходните вещества трябва да бъдат взети под внимание не.
Open съединение в катионна полимеризация има много по-висока стойност в сравнение с анионен процес. Когато анионна полимеризация е възможно да се създадат условия за растеж hitless вериги и дълго съхранение постоянна концентрация "на живо" макромолекули; Това позволява многократно "съживи" процес, чрез въвеждане на допълнителни количества мономер и по този начин да се увеличи дължината на вериги.
В катионно полимеризация живота на активни места, обикновено малки. В случай на катионна полимеризация, например, стирен и изопрен, е основната причина за образуването на продукти със степен на полимеризация не надвишава 50. общата собственост -MnM + тип активните места е тенденцията към стабилизиране чрез отделяне на протон улавяне всеки анион или изомеризация на по-стабилна състояние. Поради това, възможността за образуване на високо полимер при започване катионен се определя от процесите на растеж и стабилизиране на активни центрове. Да разгледаме реакции терминиране верига и прехвърлянето верига в катионна полимеризация:

Така полимеризацията на изобутилен в присъствие на Н + [BF3 OH] - каза терминиране и трансфер верига реакции (с изключение на (1.б)) се процедира, както следва:
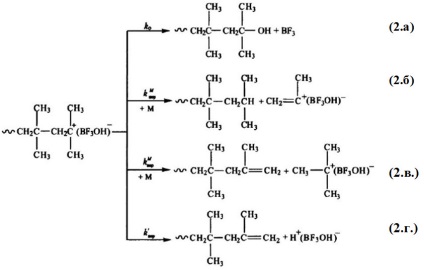
Реакциите (2.b) и (2.в) кинетично неразличими, но първите резултати в образуването на терминалния фрагмент верига наситен, а втората - ненаситен, както и реакция (2.г.). Маркирани три реакции са сходни с това, че като резултат от тяхната кинетична верига поток не се прекъсва, и всяка частица комплекс "инициатор - активатор" ( "инициатор - мономер - активатор") е в състояние да започне растеж на нова верига.
Пример за образуване на ковалентна връзка чрез взаимодействие с противойон (реакция (1.б)) е отворена верига при полимеризацията на стирен с трифлуорооцетна киселина:
Реакционната предаване на веригата на мономер не засяга скоростта на полимеризация, но помага за регулиране на дължината на полимерната макромолекула, т.е. полимер с разпределение тесен молекулно тегло.
Освен предаване на веригата на мономерните и възможна реакция трансфер разтворител, примеси или вещества, специфично въведени:
HA предаватели могат да бъдат вода, алкохоли, киселини, анхидриди, етери, естери, амини и други съединения.
Много от агенти за пренос на веригата (вода, алкохоли) често се използват като активатори следователно тяхното използване в количества в излишък от еквивалентно количество по отношение на инициатора може да доведе до увеличаване на дела на процеси трансфер верига и до намаляване на молекулното тегло.
Скорости на отделните етапи могат да бъдат записани като:
йон образуват карбонилна
Потенциалът на йонизация (йонизационна енергия) I се определя като времето, необходимо за отстраняване на електрон от атоми или молекули в газова фаза енергия:
Алкиловите радикали йонизация потенциали са дадени в таблица 2.
Таблица 2. Йонизационен принцип Йонизационните потенциали алкилови радикали
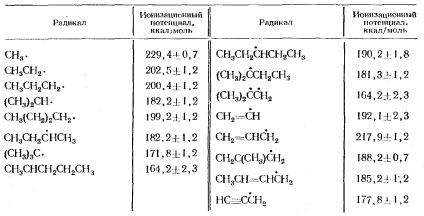
Сравнение йонизация метилови и етилови радикали показани на Фиг. 2.
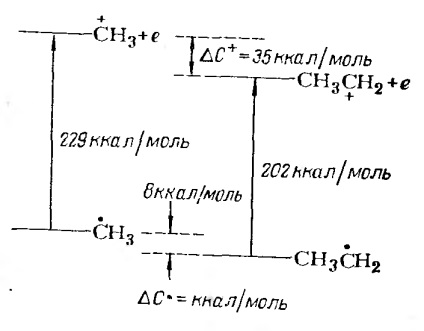
Фигура 2. Сравнение на потенциала за йонизация на метилови и етилови радикали. Енергия стабилизиране на карбониев йон # 916 С + и радикал # 916 С.
Стабилизиране карбониев йон метилова група е 147 кДж / мол (35 ккал / мол), а, като стабилизирането на радикала от метилова група е 33,6 кДж / мол (8 ккал / мол).
Proton афинитет
Важно е да се направи оценка на основните различни олефини в смисъл на афинитета на протон и йонна карбониево в съответствие с уравнения:
Афинитетът на олефин протона се определя от следните четири етапа:
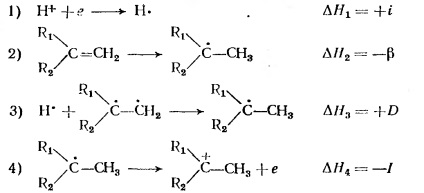
Тук - протон електронно сродство - дефинира като реципрочната стойност на потенциала йонизация на водороден атом; # 946; - разкриване на енергията на двойна връзка; D - свързваща енергия на С - Н; I - на йонизация потенциал на радикал, образуван по време на свързването на водородния атом, към олефин.
За всеки асиметричен олефинов протон афинитет ще зависи от въглеродния атом, към който е прикрепен. Данните за етилен, пропилей и изобутилен са показани в таблица 3.
Таблица 3. афинитет и протон атом (ккал / мол) до олефини
Афинитетът на карбониев йон (С1 и С2 съответно Р1 и Р2) също варира като Р1 протон афинитет (и съответно С1) и значително увеличава от етилен до изобутилен. Това обяснява факта, че реактивността на етилен се увеличава, което не е активно в катионо катализатори на изобутилен, който има висока активност. Както се вижда от Таблица 3. радикал намаляване на потенциала на йонизация води до увеличаване на протонната афинитет.
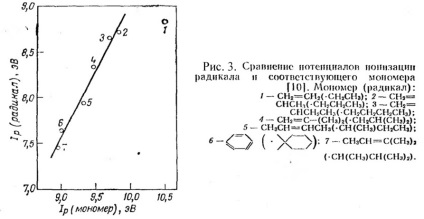
Фигура 3 показва, че йонизация потенциала на радикала и мономера са линейно свързани.
2.2.4. свободен промяната на енергия по време на образуването на карбониев йон
йон стабилност трябва да бъдат свързани с промяната на свободна енергия по време на неговото формиране.
Таблица 4. енталпии на йонизация в газова фаза
R - Br → R + + Br - (хетеролитична връзка дисоциация енергия)
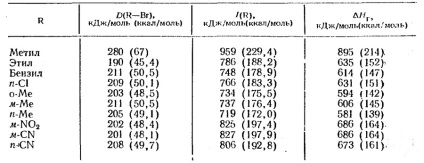
Въпреки това, за да се образува карбониев йон на алкилови халиди в газова фаза са известни само на енталпията, който се определя съгласно измерване на електронен удар и по този начин е производно хетеролитична дисоциация енергия. Тъй като съответните промени ентропията са малки, по принцип е възможно да се оцени промяната в свободната енергия от промяната на енталпията (Таблица 4.)
Енергията, необходима за дисоциация на йони на алкилхалогенид RX R + и X -. Тя може да се представи като сума от промяната на енергия в хипотетичните три етапа:
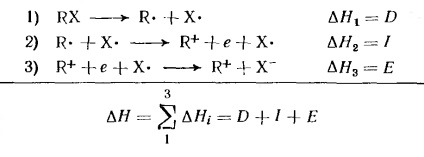
стойност # 916; H1 представлява homolytic дисоциация енергийни връзки; # 916 Н2 -ionizatsionny потенциал алкилов радикал; # 916; H3 -srodstvo електрон атом X (не зависи от природата на алкил). Йонизационен принцип Йонизационните потенциали са алкилови радикали и # 916; H-халиди в образуването на въглеродни йони, са дадени в таблица 4. Тези данни са напълно разделени йони в газова фаза. Както се вижда от таблица 4, дисоциационната енергията на алкилови съединения и потенциали на йонизация внезапно зависят от естеството на R. Образуването на газообразни йони от карбониеви Heterolysis неутрални молекули е енергоемко и следователно рядко се наблюдава експериментално.
Органични реакции, включително формирането на карбониев йон в разтвора е много по-чести.
Реакциите карбониев йон непременно включват разтваряне на йони в разтвор. Взаимодействието с разтворителя стабилизира карбониев йон и брояч йон. Тъй като стабилизация, главно поради наличието на електрически заряди, йонизирана форма ще бъде по-добре, отколкото солватирания профсъюзи. Всички разтворители допринасят някои солватация (в сравнение с газовата фаза).
Схема йонизация RX органични молекули в газова фаза и в разтвор е показан на Фигура 4. където - преходното състояние на йонизация R + и X - - разделени йони.
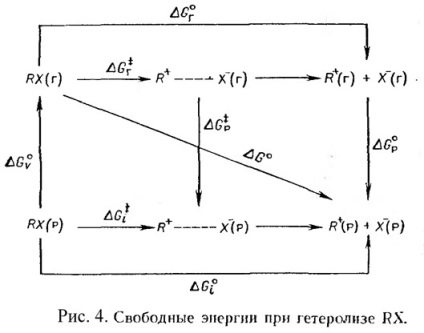
Това е, разбира се # 916; G 0 - стандартна промяна в свободна енергия на образуване на йони в разтвора на алкилхалогенид газ - трябва да бъде изразена от сумата на # 916; G 0 р + # 916; G 0 на 4. Фигурата следва:
Ion хидратация свободна енергия обикновено се изчислява чрез емпиричната уравнението често е наричан роди. Промяната на свободна енергия, когато се движат с йон радиус г д на заряда и фазата на газ към разтворител (D) е:
Според уравнение (11), на солватиране енергията на йон е по-голям в разтворители с висока проницаемост.
Също така важно е конкретната разтворимостта и поляризуемост. Очевидно е, малък радиус на разтворимите йони трябва да бъде по-добре, а това е наистина вярно за неорганични катиони. От това следва, че най-силното взаимодействие между йон и разтворителят се извършва в малък радиус йон и голяма стойност на диелектричната проницаемост на средата.
