
Начало | За нас | обратна връзка
Азотните оксиди играят ключова роля в образуването на фотохимично "смог" (вж. Съответният лекция), влияе на озоновия слой (вж. Съответният лекцията). Поради тази причина, замърсяване на атмосферата с азотни оксиди има както местни, така и глобални последици върху околната среда.
Замърсяването на атмосферата от азотни оксиди като цяло е относително малък. Въпреки това, в райони с развита химическата промишленост, по-специално в близост до инсталации за производство на азотна киселина, има локално зона на повишено съдържание на NO, NO2 във въздуха.
Азотни съединения са представени в тропосферата предимно азотни оксиди, амоняк и амониеви соли, както и азотна киселина и нитрати. Сред азотни оксиди трябва да бъдат разпределени двуазотен оксид (N2 О), оксид (NO) и азотен диоксид (N02). Други съединения от азот и кислород (N03. 2O 3. 2O 4. 2O 5) в тропосферата са нестабилни. По този начин, двуазотен триоксид и двуазотен тетраоксид лесно се разгражда до образуване NO и NO2:
азот триоксид относително бързо се подлага на дисоциация или взаимодейства с други примеси:
Двуазотен пентоксид е нестабилен в тропосферата и съединението се разлага до образуване двуазотен триоксид и кислород под действието на влага или превръща в азотна киселина:
Следователно, съгласно обща формула NOx азотни оксиди обикновено включват NO, N02 и N2 0.
Основни методи на N2 О 0 на атмосферата, свързани с потока от процеси фотодисоциация:
или чрез взаимодействие с синглет възбуден кислороден атом:
N2 + 0 0 (1 D) ® 2NO
Последните две реакции протичат с приблизително същата скорост. Тъй като концентрацията в тропосферата синглет възбудени кислородни атоми е ниска и почти никой от радиация с дължина на вълната 250 нм л £, N2 O молекули притежават дълъг живот и могат да се движат в стратосферата. В стратосферата поради повишена концентрация на 0 (1 D) атоми и процесите на промяна на спектъра на слънчевата радиация процент на унищожаване на молекули N2 O увеличава преминаване драстично. Следователно, концентрацията на N2 О при 35 км е приблизително 10 пъти по-малко, отколкото в тропосферата.
Основните природни източници на азотни оксиди (денитрификация процеси, NH3 окисление. Окисление и отделянето на азот светкавица) годишно в тропосферата доставят от 21 до 89 милиона тона NOx изчислени като елементарен азот. Освен това, в резултат на антропогенни емисии все още около 20 милиона тона азот под формата на оксиди, изпускани в атмосферата. Естествени и синтетични емисии на азотни оксиди за предпочитане съдържат NO.
Един от основните източници на азотен оксид е окислението на атмосферен азот, който придружава всички горивни процеси, в които въздухът се използва като окислител. С повишаване на температурата увеличава равновесие количество азот оксид във въздуха. Процеси изкопаеми горива топлоелектрически централи и изгаряне на гориво в превозни средства двигатели са основните източници на атмосферното замърсяване с азотни оксиди.
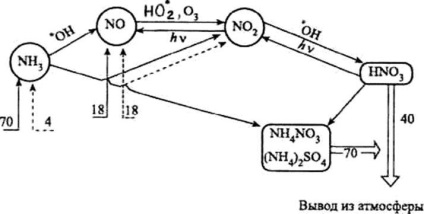
Атмосферните азотни пръстенни съединения (номера - елементарен азот милиона тона годишно):
® - Входящи природен азотни съединения;
---® - Входящи антропогенни азотни съединения;
Þ - отнемане от атмосферата
В тропосферата, N0, взаимодейства с хидропероксид радикал, азотен диоксид става:
Друг възможен начин за окисление на азотния оксид - взаимодействие с озон:
Азотният диоксид в присъствието на тропосферата радиация дължина на вълната л <398 нм разлагается с образованием оксида азота и атома кислорода:
Получената азотен моноксид отново подложени на процеса на окисляване и атомен кислород води до появата на озон в тропосферата.
Важна част от цикъла на атмосферни азотни съединения (вж. Фиг.) Е образуването на азотна киселина. Приблизително 44% азотна киселина в тропосферата се образува чрез реакция на азотен диоксид с хидроксил радикал:
За 24% HNO3 появява в атмосферата в резултат на взаимодействие с молекули двуазотен пентоксид Н2 0, съгласно уравнение (1). До 28% от азотна киселина, освободена в атмосферата се образува чрез взаимодействие на азот триоксид с органични кислород-съдържащи радикали.
Част азотна киселина се разлага до образуване на азотен диоксид или триоксид, който отново включен в атмосферно цикъл азотни съединения (виж фиг ..):
За разлика от сярна киселина, азотна, могат да останат дълго време в атмосферата в газообразно състояние, тъй като той е слабо кондензира. изпарения азотна киселина се абсорбират в атмосфера на капки или частици аерозолен облак.
Основният размер на азотна киселина е получен от тропосферата с утаяване под формата на разтвори HN03 и неговите соли.
Важна роля при атмосферни процеси, включващи амоняк азотни съединения играе. Водният разтвор на амоняк е алкална, при атмосферно може да неутрализира киселинни съединения:
Тези химични реакции води до образуването на сулфат и амониев нитрат.
Основният източник на атмосферно амоняк е почва. В почвеното органично вещество податливи на микробиологична деградация. Амонякът е един от продуктите на разграждане на органична материя. Особено голямо количество амоняк освободен в процеса на разлагане на урина на домашни животни. Например, в Европа, този източник е още по-значително, отколкото отделянето на амоняк от почвата. Тя служи като важен източник на производството и включване в почвата на азотни торове. Освобождаване на амоняк в атмосферата от изгарянето на въглища гориво или моторно леко.
Годишно от естествени източници в атмосферата идва около 70 тона NH3 милиона въз основа на азот. Антропогенни принос за замърсяването на атмосферата с амоняк е само на около 4 милиона тона.
С утаяването и получените сух отлагане процеси годишно около 70 милиона тона амониеви съединения, получени от атмосферата. Част амоняк (от 3 до 8 милиона тона годишно) взаимодейства със свободните радикали, предимно с хидроксил радикал:
Впоследствие · NH2 лесно се окислява до азотен монооксид.
Свързани статии
