
Начало | За нас | обратна връзка
Входящите Основни неорганични серни съединения в тропосферата свързани с антропогенни източници. Те представляват приблизително 65% от всички постъпления неорганични серни съединения в атмосферата. Около 95% от това количество серен диоксид.
Входящи от природни източници на неорганични серни съединения трябва да разпределят вълна активност в океаните, което води до образуването на аерозоли. Общият размер на сяра, съдържаща се в аерозол под формата на калциеви и магнезиеви сулфати, се оценява на 44 милиона тона годишно, което представлява приблизително 30% от това в атмосферата под формата на неорганични съединения.
Както е отбелязано по-горе, има процеси в тропосферата окисляването на серни съединения, в които основната окислителя служат свободни радикали. Сероводород, например, последователно на няколко етапа окислява до SO2. Подробната механизма на този процес все още не е определен. Най-вероятното развитие на следните реакции:
HS · + 02 ® SO + · ОН
Полученият серен диоксид като S02. идващи от други източници, той се окислява по-нататък. Механизмът на този процес се изучава по-подробно.
Окислението на серен диоксид може да се осъществи в газова фаза - първи път в твърда фаза (окислява адсорбция предхожда) - втори път и в течната фаза (окисление предхожда абсорбция) - третия път.
Окислението на газова фаза (първи път) исторически е първият опит да обясни процеса на окисление на серен диоксид в атмосферата. В продължение на много години основният механизъм на процеса, свързан с образуването на серен диоксид в възбудено състояние, което реагира с молекулен кислород образува SO3:
Създадена SO3 реагира с молекула вода:
Въпреки това, както е показано от проучвания през последните десетилетия, този механизъм е възможно, но не е основният процес на окисление на SO2 в газова фаза.
По този начин механизмът за окисляване не играе значителна роля в превръщането на серни съединения в тропосферата, водеща роля играе свободни радикали. Настъпили по време на този процес може да се представи чрез следното уравнение:
Серен триоксид - серен диоксид - лесно реагира с атмосферни частици влага и образува разтвор на сярна киселина [виж. Уравнение (1)], което реагира с амоняк или с метални йони, присъстващи в атмосферни частици влага частично превърнати в съответните сулфати. По същество това е амониев сулфат, натрий, калций. образуване на сулфат възниква в процеса на окисляване на повърхността на твърди частици във въздуха. В този случай, етапът на окисление предхожда адсорбцията, често придружени от химическа реакция (втори път серен диоксид окисление):
Третият начин за окисление на серен диоксид в тропосферата се свързва с предварително абсорбцията на SO2 капки към атмосферната влага. В дъждовен време и при висока влажност на въздуха окислител този начин може да бъде ключов в процеса на трансформация на серен диоксид. Като окисляващ агент в естествени условия често действа водороден пероксид. При високо рН, когато в разтвор са основно йони SO3 2-. скоростта на окисляване увеличава значително. Крайният продукт на окисление, както е в случая на газова фаза на окисляване, е сярна киселина, която след това може да отиде до сулфати.
Освен химични процеси на преобразуване на серен диоксид към киселина и сулфати изтичане сярна (продукция от атмосферата) на тези съединения се дължи на мокри процеси (с утаяване) и сух (в контакт с повърхността на почвата, езерото или растителност) отлагане.
Показано на фиг. тропосферата диаграма илюстрира част от цикъла на неорганични серни съединения.
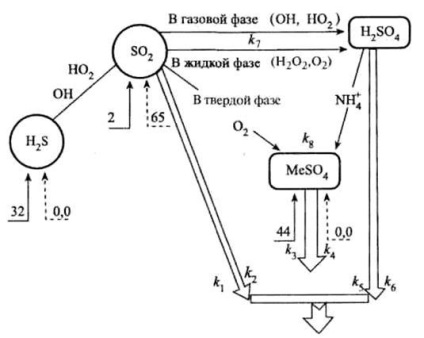
Превръщането на неорганични серни съединения в тропосферата (броя - милиона тона елементарна сяра годишно):
Входящите ® Natural серни съединения;
---Входящите ® антропогенни серни съединения;
Þ изход от атмосферата.
Трябва да се отбележи, че серният диоксид - един от най-вредните газове измежду обикновените замърсители на въздуха. Това е особено опасно за здравето на хората, страдащи от респираторни заболявания. Линейна зависимост между концентрацията на SO2 в въздух и популации честота NY Zabolev с хроничен бронхит:
където - процентът на бронхит; х - концентрация на SO2 на въздух, мг / м3.
От тази връзка следва, че когато концентрацията на SO2 във въздуха на 0.5 мг / м 3 бронхит честота в популацията ще бъде 6% при концентрация 1.0 мг / м 3 - с 5 мг / м 3 13,2% - 71, 2%, и при концентрация 6.8 мг / м 3, всички популации болен бронхит. Тези прогнози съвпадат с резултатите от проучвания, проведени в Германия и други европейски страни.
Основната щети на околната среда не толкова SO2. като неговото окисление продукт - SO3. От тогава образуването на атмосферна влага сярна киселина [виж. Уравнение (1)], и това води до загуба на т.нар киселинен дъжд. Особено Разпространение-Нено това явление в Скандинавия, Северна Европа, САЩ север и на юг от Канада. Поради киселина дъжд намалява рН на сладководни органи, което води до смъртта на риба и други водни организми (вж. Лекция за подкисляване на водни басейни). Под действието на киселина дъжд бързо корозират метал, целостта се нарушават lakokra богати покрития са унищожени сгради и паметници. Така атмосферно сярна киселина реагира с мрамор (СаСО3) за образуване CaSO4. което води до каменния лющене.
В кисела среда увеличава разтворимостта на Al (ОН) 3 В-ЛИЗАЦИЯ концентрация> 0.2 мг / л Al 3+ йони във вода е токсичен за риби, освен алуминий свързва фосфат, което намалява резерв хранителен в резервоара. В кисела среда увеличава възможността за преход в разтвора и други метални йони, което създава риск от токсичното замърсяване на водата и почвата екосистеми.
Киселинен дъжд засяга структурата и структурата на почвата, води до смърт на растенията (предимно иглолистни). Когато киселинността на почвата се извличане на калций, магнезий и калий, количка топене йон мобилност токсични метали, промяна на състава на почвата микроорганизми.
Свързани статии
