Азот образува редица оксиди, съответстващи на всички възможни официални окисление на 1-5: N2 О, NO, N2 О3. NO2. 2O 5. но само две от тях - азотен оксид (II) и азотен оксид (IV) - не само стабилен при нормални условия, но активно участва в естествен и промишлено цикъл азот.
1.2.1 Някои от азотни съединения и техните свойства
азотни оксиди
N2 + 1 О - азотен оксид (I), азотен оксид, "смее" газ nesoleobrazuyuschy оксид. Получават N2 О разлагане на амониевия нитрат:
N2 O има слаб приятен аромат и сладък вкус. С кислород, вода, киселини и основи не реагират. Разлага на елементи при температура над 500 ° С, с други думи, достатъчно стабилна.
Структура :, Y 3 азот при 2 кислород несдвоен електрон - се образува двойна връзка и една несдвоен електрон в радикал. Може да се предположи, че молекулите на NO ще мате и образуват димерен молекула Onno. Молекулярна структура: линейна молекула O = N = N, в която централната N атом е четиривалентен. Той образува две двойни връзки: един - с кислород типична схема създава ковалентна връзка (два азотни електрон, два кислородни електрони) и от друга - с азотния атом, (което две от три несдвоени електронни двойки и образуващи по този начин празна орбитала) един на ковалентни връзки, втората донор-акцептор (фиг. 1). Устройство за производство на азотен оксид (I) се състои от опори, епруветки, тръби с изходен отвор за газ тръба, цилиндърът плесен и дух лампа (фиг. 2). Епруветката се поставя NH4 NO3. запушалка с тръба за газ разреждане и се нагрява. Газ събира в бутилка, пълна с вода.
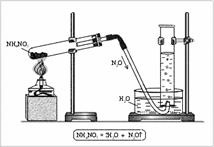

Фиг. 2. Получаване на азотен оксид (I) в лабораторията
Оксид N2 О разлага при нагряване:
Оксид N2 О взаимодейства с водород:
N 2 O - азотен оксид (II). nesoleobrazuyuschy оксид. Получава се чрез взаимодействие на NO с HNO3 киселина меден (разредена.) (Фиг. 3).
Кристалната решетка на молекулните; молекула леко, слабо полярен (кислород малко по-висока Електроотрицателност от азот). Може да се предположи, че точките на топене и точките на кипене са ниски, но по-висока от тази на азот, т.е.. К. полярността на молекулите прави възможно свързването на електростатичния силата на привличане на просто междумолекулни сили. образуване на димер също допринася за точката на кипене. Молекулярна структура предлага и ниска разтворимост във вода. Азотният оксид (II) не цветове, без мирис.
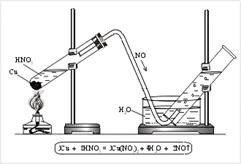

Фиг. 3. Получаване на азотния оксид (II) в лабораторията
За азотен оксид (II) се поставя в епруветка малко медни стружки и се излива разредена азотна киселина. Епруветката се запушва с изходен отвор за газ тръба и укрепване в стелажа. Краят на тръбата за пара се спуска в матрицата с вода и след това в цилиндъра (фиг. 3). При нагряване означава NO. NO е лесно окислява от атмосферен кислород, т.е. действа като редуктор ..:
Реакцията с NO серния оксид газ - окислител:
N + 22O3 - азотен оксид (III). азотен анхидрид (съответства HNO2 азотиста киселина и нитрит соли); е кисела оксид, се характеризира с всички свойства на кисели окиси. Оксид се получава чрез взаимодействие на 2O 3:
Да разгледаме азотни електрони на молекула на NO. Това несдвоен електрон, свободна електронна двойка и два електрона да се свържат с кислород - само пет. Но кислородният атом ", идващ върху връзката" шест електрони в четири орбити. Ако ние ги подредите по две, а след това един орбитален остава безплатно. Това го и двойка електрони с азотния атом се (фиг. 4, 5).
Фиг. 4. Веригата на електронната структура на NO2 на молекула (първи вариант). (Dots показват електрони О атоми, пресича - N атом електрони)
Фиг. 5. схема на електронната структура на NO2 на молекула (втори вариант). (Звездичка означава възбудено атом О, стрелка - донор-акцептор връзка.
Всяка двойка електрони, разположен на S-орбитални ", продължи връзката", това просто е задължен да премине хибридизация. Въпросът е какъв тип хибридизация използва атома? Отговор: Трите електрон орбитите на азот са в SP 2 хибридизация. Молекула ъгъл NO2, 134 ° ъгъл (ъгъл по-голям от 120 °, защото един електрон отблъсква електрони от съобщение по-слаба от електронна двойка) (фиг. 6, 7).
Кристална молекулна решетка, обаче, тъй като NO молекулата си е по-тежък и тенденцията да се димеризира в това значително по-висока стопилка на кипене и след това вещество трябва да бъде много по-високи температури. Точката на кипене е 21 ° С, но при нормални условия - 20 ° С и 760 mm Hg. Чл. - азотен оксид (IV) течност.
Азотният оксид (IV) се разтваря във вода, докато взаимодействие с него и това се получава от само два киселини.
Фиг. 7. Молекула NO2- изглед "страна", от връзката донор-акцептор. (. Вторият кислороден атом не е видима за атом орбитите азотните сенчести кръгове -. Се хибридизират орбитали атоми насочени към читателя)
Азотният оксид (IV) и има характерен остра миризма и светлокафяво цветови нюанси, които се различават един от друг в зависимост от концентрацията. Тя е за този цвят емисиите на азотни оксиди в атмосферата се нарича "лисича опашка" [4].
3) димеризацията при охлаждане:
При температура -11 ° С равновесието е напълно измества надясно, и при 140 ° С - изцяло наляво.
1.2.1.2 Азотна киселина
Хидроксиди на азот, се считат за най-голям тонаж - азотна киселина.
молекула на азотна киселина е полярен (поради различни Електроотрицателност на кислород и водород, защото азота както е скрит в молекулата) и асиметрична. Всички три разположение на това ъгълът между връзките на азот и кислород са различни. Формално-висока степен на окисление на азот (5). Но в този случай само четири връзка при азотния атом с други атоми, - азот валентността е 4.
В структурата на молекулата е по-лесно да се разбере, ако вземем предвид в процеса на изготвянето му. Азотна киселина се получава чрез взаимодействие на азотен оксид (IV), с вода (в присъствието на кислород): две молекули NO2 едновременно "атака" молекула вода с техните несдвоени електрони, което води връзка на водород и кислород е счупен, не както обикновено (електронна двойка на кислорода и "празна протон "), и една молекула от водород, NO2 получава своята електрони, от друга - оН радикал (Фигура 8) .. Създадена две киселини: и двете силни киселини, както бързо дават техните протонни близката молекули вода и са обобщени под формата на йони NO2 - и NO3 -. Ion NO2 - е нестабилна, двете молекули се разлага във вода HNO2, NO2 и NO. NO оксид реагира с кислорода, разработване на NO2. и така до тогава, докато не получите само една азотна киселина.
Фиг. 8. Схема на образуването на молекули на азотна и азотни киселини. (Черна топка - атом N, големи бели топки - атомите О, малки бели перли - Н. атома)
Формално, изглежда, че един кислороден атом свързан към азотния атом на двойна връзка, и от друга - конвенционална единична връзка (този кислороден атом и свързан водороден атом). С третия кислороден атом свързан към азота в HNO3 донор-акцептор връзка, и служи като донор на азотен атом. Хибридизация с азотния атом, трябва да бъде SP 2, поради наличието на двойна връзка, който определя структурата - плосък триъгълник. Всъщност изглежда, че наистина фрагмент от азотни атома и три кислородни атома - плосък триъгълник, само в молекулата на азотна киселина този триъгълник неправилни - Оно трите ъгли са различни, следователно, различни страни на триъгълника. Когато молекулата се разпада, триъгълника става прав, равностранен. Следователно, кислородните атоми в него стават равни. Са еднакви и всички връзки.
Физични свойства на азотна киселина
Съединение йонизиран, дори частично, е трудно да се прехвърли в газа. По този начин температурата на кипене трябва да бъде достатъчно висока, но в такова ниско молекулно тегло висока температура на топене, не трябва да бъде. Следователно, състоянието на агрегация при 20 ° С течност. По отношение на разтворимост, то, както и много други полярни течности, азотна киселина е лесно се смесва с вода във всякакви пропорции. Pure азотна киселина са безцветни и без миризма. Въпреки това, поради разграждането на кислород и азот оксид (IV), което се разтваря, и може да се каже, че конвенционалният концентрирана азотна киселина има жълто-кафяв цвят и характерен остра миризма NO2. Нека да видим, как структурата на молекулата на азотна киселина върху неговите химически свойства.
HNO3 - окислител на Мощен
В реакцията на HNO3 с метали (М) се освобождава водород:
М + HNO3 сол + вода + газ.
Смес от HNO3 (конц.) Със солна киселина В обемно съотношение 1 (конц.): 3 (1V HNO3 + 3V HCl), наречена "царска вода".
Азотна киселина не реагира с други киселини от тип обменни реакции или съединения. Въпреки това, тя е в състояние да реагира като силен окислител. В смес от концентрирана азотна и солна киселини появят обратими реакции, същността на който може да се обобщи по уравнението:
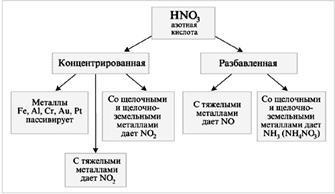

Получената атомен хлора е много активна и лесно избира електрони от метални атоми, и хлорид йон образува се получава стабилен комплекс йони с металните йони. Всичко това ни позволява да се прехвърля разтворът дори злато. Концентрирана H 2SO 4 като дехидратиращ агент спомага силна реакция разлагане азотна киселина на азотен оксид (IV) и кислород. Азотна киселина - един от силни неорганични киселини и, разбира се, да реагират с основи. Той също реагира с неразтворими хидроксиди, основни оксиди и [4].
В проучване на тема "Азот. Азотни съединения "учебник химия са редактирани GE Rudzītis, FG Фелдман също учебник за 9 клас, под редакцията на NS Ахметов. Дидактическа материал е книга на химията за класове 8-9, под редакцията на М. Радецки, В. Горшков; употребявани задачи за независими роботи в химията за степен 9, редактирани от RP Surovtsev SV Софронова; колекция от задачи, използвани в химия за средните и висшите училища, идващи под редакцията на GP Khomchenko, IG Khomchenko. На изследване начинаещи разпределени 7 ч [3, 5].
Продължи към изтеглянето на файла
Свързани статии
