Уравнението на Ван дер Ваалс свързва основните термодинамични параметри за недвижими газ.
При ниски налягания и високи температури Менделеев-Клапейрон закон също доста точно описва поведението на реални газове, но и други газове действителните условия се отклоняват значително от идеала. Уравнението на ван дер Ваалс сили позволява тези отклонения.
Формулата на ван дер Ваалс
Уравнението на ван дер Ваалс има формата:
В това уравнение, п - брой на моловете на газ, стр - налягането. V - обем заето от газа, Т - абсолютната температура на газа. Universal постоянен газ има стойност от 8,31441 J / (мол • К), еднакъв за всички газове.
Частично както и - това е изменение на силата на привличане между газови молекули. Под влияние на тази сила молекулите са привлечени един към друг в газа, намаляване на налягането на стената. Променлива б - корекция поради своя обем заета от молекулите на газа. Тези изменения ще зависят от вида на газ, и могат да се намерят в таблици или изчисляват по следните формули:
Тук и - налягане и абсолютната температура на газа в критичната точка, т.е. при температурата на преход на газовата фаза в течността.
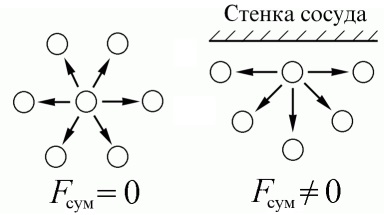
В реалния разстоянието между молекулите на газа е по-малко отколкото за идеални и сравним с размера на самите молекули. Следователно силата на взаимодействие между молекули стане достатъчно голям. Обемът на молекула газ е заобиколен от всички страни от други молекули, както и техните привличане сили са балансирани. Въпреки това, когато молекулата е в близост до стената, привлекателната сила вече не е балансиран и "изсмуква" в него. Ето защо, на молекулата се движи към стената бавно, поради което се намалява налягането на стена. Това изменение отчита кладенеца.
Освен това, поради междумолекулни сили реални газове могат да преминават в течно състояние и уравнението на ван дер Ваалс доста точно описва поведението на газове в близост до този преход.
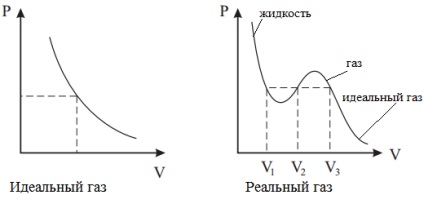
Тъй като в реална газ разстоянието между молекулите е относително малък, молекулата е да се лети по-кратко разстояние да се удари в стената. Ето защо, при много високи налягания се увеличава натиска върху стената, и това дава възможност за корекция на б.
Уравнението на ван дер Ваалс сила се прилага, по-специално при определянето на двойката параметри в топлина и топлотехническо в изследването на втечняване на газ.
Примери за решаване на проблеми
Какво температура е азот тегло 2 грама, която заема обема на 800 см при налягане от 0,2 МРа, когато се разглежда като реален газ?
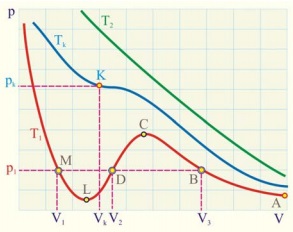
Увеличаването уравнение на ван дер Ваалс сили и за разделяне на р, ние получаваме уравнението за кубичен обем:
Това уравнение има три корени. инфлексна точка е показано на фигурата, всички корени са реални и равни. инфлексната точка е критичната точка, в който газовата фаза в течността.
За критичните параметри, използват свойствата на инфлексната точка: първата и втората производна на уравнението изчезне.
Ние решаваме тези уравнения за обем и температура, които получаваме критичните параметри:
Изразяване на налягане от уравнението на ван дер Ваалс и писане уравнението за критичните параметри, ние получаваме:
Заместител при това уравнение, и след получаване на разтвора:
Пишем на системата уравнения:
Нека да разберете от него б:
Заместването б в второто уравнение, получаваме:
Свързани статии
