Най-прости и качествено отразява правилно реалната поведението на газа. е Ван дер Ваалс сили:
(P + а / п 2) · (п - б) = R · Т. (6.3)
а, Ь - константна величина, първата сила взаимодействието предвид, вторият взема предвид размера на молекулите.
а / N 2 - характеризира допълнително налягане. при които има действителната газ се дължи на кохезивни сили между молекули и се нарича вътрешно налягане. За течност тяло, това налягане има големи стойности (например, вода при 20 0 С от 1050 МРа), а за газове поради малките кохезионни сили на молекулите е много малък. Ето защо, външния натиск. при които има течност. Той има незначителен ефект върху обема си и течността се счита несвиваем. Газовете са много малки стойности на / п 2 външен натиск лесно да се промени техния обем.
Уравнението на ван дер Ваалс качествено правилно отразява поведението на течни и газообразни вещества. за двуфазен състояние не е приложим.
На PV - диаграма (фигура 6.1) показват изотерми Ван дер Ваалс конструирана съгласно уравнението. Това се вижда от кривите че вълнообразни участъци са при относително ниски температури. Колкото по-висока температура. по-късата част на кривите. Тези криви показват вълнообразни непрекъснат преход от течно състояние в пара при дадена температура. точка А, съответства на течно състояние. Точката прилага изпарява вещества.
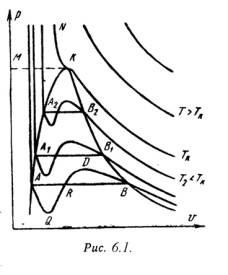
В действителност, преходът от течно състояние в пара винаги става чрез двуфазова състояние на материята на. Така при дадена температура преход се случва при постоянно налягане. След валиден преход от течност до пара е представена с права линия AB.
На практика много чисти вещества могат да упражняват области Waveform AQ и DB. В първия случай, има нестабилното състояние на прегрята течност. а втората - на преохлажда пара.
При определена температура изотерма уравнение на ван дер Ваалс сили не ще имат вълнообразно част (точка Л). Това се нарича критичната температура. Ако свържете точката А1. А2. ... А3 и В1. В2. B3. Ние се получи крива, подобна на парабола. Крива АА се нарича долната граница крива и съответства на състоянието на кипене течност. крива HF се нарича горна граница крива и съответства на състоянието на сух наситен пара.
Така PV реална вещество - схемата може да бъде разделена на три области:
1 - областта на течно състояние, се намира отляво на долната граница крива;
2 - две фаза състояния област (мокра пара) е разположена между долната и горната граница кривата);
3 - площ на прегрята пара. намира в горната дясна част на кривата на граница и над критичната точка. Условно регион ограничи течност най-горния ред KM - критичен изобар.
Връзката между критичните параметри и константи на ван дер Ваалс на:
дер Ваалс микробуса газ при високи плътности предлага значителни грешки. Също експериментално доказано, че коефициентите а, Ь зависят от температурата и налягането. и тази зависимост е много сложно.
M.P.Vukalovich I.I.Novikov и през 1939 г. предложи нов универсален уравнение на състоянието на реални газове с оглед на сдружението и разпадането на молекулите. който е както следва:
(P + а / п 2) · (п - б) = R · T (1 - C / (п · T (3 + 2 m) / 2) (6,6)
С, м - константи се определят от експерименталните данни.
Свързани статии
