Термодинамична термодинамично хомогенна фаза част от свойствата на термодинамична система, отделен от други интерфейсни повърхности, върху които определени свойства се променят рязко система 1.
В различни фази на една система компонент може да бъде представен в различни агрегатни състояния или различни полиморфни модификации на едно вещество. Фазата на система мулти-компонент може да бъде с различен състав и структура.
Газ винаги се състои от една фаза флуид може да се състои от множество течни фази с различни състави, но две различни течности на състава не могат да съществуват в равновесие. Веществото в твърдо състояние може да се състои от няколко фази, някои от които могат да имат същия състав, но различни структури (полиморфи, Алотропия).
Физическа Етап- състояние на материята характеризира с някои качествени свойства - способност или неспособност да се поддържа обемът и форма, присъствието или отсъствието на далечни разстояния и за къси разстояния и други.
Промяната на агрегатното състояние е съпроводено с рязка промяна в свободната енергия, ентропия, плътността и други физически свойства на ядрото. Има следните състояния на агрегация: твърдо тяло, течност, газ, плазма.
Комплект термодинамични фази обикновено са много по-богат набор от агрегирани състояния, т.е. същото състояние на материята може да бъде в различни термодинамични фази (лед, например, се случва в пет различни версии - фази). Ето защо този въпрос е описано от гледна точка на състояния на агрегация, а грубост, и то не може да се прави разлика между определени физически различни ситуации.
Във всеки случай, наличието на фазовия преход означава възможност по принцип вещество от една фаза към друга.
Фазовият преход (промяна на фазите) в термодинамиката - прехода на вещество от една термодинамична фаза в друга като промяна условия.
температура, налягане или друга физическа величина, в която фазови преходи срещат в система с един компонент, се нарича точка на преход.
Пример за преминаване на фаза-Ne може да промени в агрегатното състояние на веществото или преходите, свързани с промени в състава, изграждане SRI и свойства на веществото (например, NE Преминаване-кристално вещество от OD-дългосрочни изменения на другия).
Тъй като отделянето на термодинамичен фаза - по-фина условия класификация от разделянето на агрегатното състояние на веществото, тогава не всеки преход фаза се придружава от промяна на сборната състояние. Въпреки това, всяка промяна в агрегатното състояние на фазов преход.
Разграничаване два вида фазови преходи.
Фаза преход (например, топене, кристализация и т.н.), придружен от абсорбцията или освобождаването на топлина, наречен топлината на фазов преход.
Когато първият фазов преход за рязко променя най-важните, обширни основни параметри: специфичният обем, размерът на вътрешната енергия, съхранявана на концентрацията на компонентите и др ...
Най-често срещаните примери на фазовите преходи: топене и кристализация, изпаряване и кондензация, сублимация и десублимация.
Фазови преходи се характеризират с постоянството на температура, промяна на ентропията и обем. Обяснението за това може да се даде, както следва.
Съгласно скокообразно изменение на материала се разбира скок, когато температурата и налягането. В действителност обаче, засягащи системата, ние не се променят тези стойности, както и обема и общото му вътрешна енергия. Тази промяна е винаги е така с някои крайни скорост, което означава, че за да се "покрият" цялата разликата в плътността и относителната вътрешната енергия, ние се нуждаем от определено време. През това време, фазовия преход не е настъпила незабавно в целия обем на веществото, но постепенно. В случай на първия фазов преход за се разпределя (или взети) определено количество енергия, която се нарича латентна топлина на фазов преход. Фазов преход не е спряна, той е длъжен извежда непрекъснато (или сума) е топлина или компенсиране на изпълнението на работата в системата.
Например, чрез стопяване на тялото трябва да бъдат докладвани на определено количество топлина, за да доведе до разрушаване на кристалната решетка. Предоставеният топлината в топенето на тялото не идва на отоплението и разкъсване на interatomic облигации, така топене се случва при постоянна температура. В такива преходи - от по-подредена кристално състояние на по-малко нареди течно състояние - степента на разстройство се увеличава и, от гледна точка на втория закон на термодинамиката на този процес е свързан с увеличаване на ентропията на системата. В случай на преход в обратна посока (кристализация), системата подчертава топлината.
Фазови преходи, които не са за поглъщане или освобождаване на топлина и промяна силата на звука, се наричат фазови преходи от втория вид.
Тези преходи се характеризират с постоянството на обема и ентропията. Плътността на вътрешната енергия също не се променя, така че просто око, като преход фаза не може да се вижда. Прехвърляне и тестване техни производни по отношение на температура и налягане: специфичната топлина, коефициент на термично разширение, висока чувствителност и др ...
Общото лечение на фазови преходи II-O вид, предложен от съветски учен Ландау (1908-1968). Според тази интерпретация, преходите ред на фаза II, свързани с промени в симетрия-RII: над точката на преход, системата обикновено има по-висока симетрия, Ria, долната преход точка.
Най-често срещаните примери на фазовите преходи: системата за преминаване през критичната точка, парамагнитни преходния или феромагнитен-парамагнитни - antiferromagnet, преходни метали и сплави в състояние на свръхпроводящ, преходът на течен хелий в СУПЕРФЛУИД състояние, преходът от аморфен материал в стъкловидно състояние.
Съвременната физика разглежда също системи с фазови преходи на трета или по-висок ред. Напоследък широко разпространената представа за квантов преход фаза, т.е. фазов преход не се задвижва от класическите флуктуация и квантовата че съществуват дори в абсолютна нула температура.
фазови преходи участък на две родове е малко произволни, тъй като има фазови преходи на първия вид с малки скокове на параметъра за и малки серии на преход за силно развити колебания. Това е най-характерни за преходите между фазите на течни кристали.
Топенето твърди частици
Пример за преход от първи ред е топене и кристализация на твърди вещества. процес на топене играе важна роля в природата (сняг и лед върху земната повърхност, стопяване на минерали в неговата вътрешност, и т.н.) и в областта (производство на метали и сплави, леене във форми и др.).
Plavlenie- тяло е преходът от кристално твърдо вещество към течност.
Основните характеристики на топене чисти химикали се топят температура (Тт) и се загрява (топлина на стапяне QPL) необходими за процеса на топене.
В процеса на температура кристал топене остава постоянна. Тази температура се нарича температура на топене Тт на. , Всяка субстанция има своя собствена температура на топене. Температурата на топене на даден материал зависи от атмосферното налягане. Най-високата точка на топене между чисти метали е волфрам (3410 ° С), най-ниската -
живак (-38,9 ° С).
постоянна температура се дължи на факта, че топене на целия вход за нагряване е в неправилност редовен пространственото разположение на атоми (молекули) в кристалната решетка. За повечето кристали (различни от вода, както и някои сплави), температура на топене нараства с увеличаване на външен натиск, тъй атома раздалечаващи един от друг на по-високо налягане изисква повече енергия термични движения, т. Е. по-висока температура.
Стопеният материал има голям вътрешен марж енергия, отколкото в твърдо състояние. Останалата част от топлината на топене се консумира за извършване на работа, за да промените силата на звука на тялото по време на топене. При топене, обемът на повечето увеличава кристални твърди вещества (3-6%), и намалява по време на втвърдяване. Но има вещества, в които в обема на топене намалява и по време на втвърдяване - увеличава. Те включват, например, вода, желязо, силиций и др. Ето защо лед плава върху водата, а твърдият актьорския състав - в собствената си стопилка.
Топене започва, когато т.т. на кристално вещество. От началото до завършване на температурата на топене на материала остава постоянна и равна на Тт за вещество, въпреки топлина (фиг. 1). Загрява кристал към Т> Тт при нормални условия не е възможно, докато значително преохлаждане на стопилката се постига сравнително лесно по време на кристализацията.
Топене случва с абсорбцията на латентна топлина на фазов преход - топлина на топене QPL на ..
Специфична топлина на стапяне QPL. Тя показва количеството топлина, необходима за пълно превръщане на 1 кг вещество от твърдото вещество в течно състояние, взети на температурата на топене. QPL. = QPL. / M, J / кг.
Топене придружава от промени във физическите свойства на: увеличаване на ентропията, което отразява нарушено кристалната структура на веществото; увеличаване на капацитета на топлина, електрическо съпротивление. Пада до почти нула при топене устойчивост на срязване намалява скоростта на звука размножаване (надлъжни вълни), и т.н.
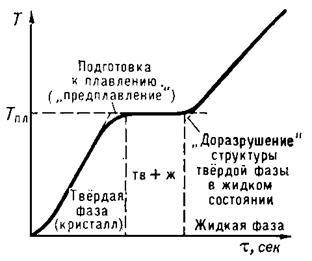
Фиг. 1. Спиране на температурата на топене на кристалната структура.
На абсцисата представлява времето # 964; пропорционално нанася равномерно върху количеството топлина тялото.
Според молекулните кинетични представяния, топене се провежда както следва. Когато обобщаващи кристална топлина на тялото увеличава енергията вибрации (вибрации амплитуда) на неговите атоми, което води до повишаване на телесната температура и спомага за образуването на кристал на различни дефекти (незаети кристалната решетка точки - позиция; разстройства периодичността на решетъчни атоми, инфилтрирани между нейните възли и т.н. . молекулните кристали могат да бъдат частично неправилност на взаимна ориентация на молекулните оси, когато молекули не имат сферична форма. постепенно увеличаване на броя на дефекти характеризират стъпка им premelting асоциация. С постигането на Тм в кристални дефекти създадена критична концентрация започва plavlenie- кристалната решетка разбива тече подмикроскопско регион. Предоставеният топлината в топенето на тялото не идва на отоплението и разкъсване на interatomic облигации и унищожаване на дългосрочен порядък в кристали. В самите като подмикроскопичните области за къси разстояния в подредбата на атомите при топене не се променя значително. Това обяснява по-ниските стойности QPL топлина на стапяне сравнение с топлината на изпарение и относително малки промени в редица физични свойства на вещества, когато те се топят. Тъй като температурата се увеличава молекулите се движат повече и повече интензивни. При нагряване, не само увеличава молекулното кинетичната енергия на тялото, но също така и потенциалната енергия на неговите атоми, тъй като с увеличаване на амплитудата на осцилации атома далеч един от друг по-голямо разстояние и подход всеки друг на малко разстояние, така че енергията взаимодействие на техните електрически увеличава зареждане. С повишаване на температурата се появява накрая такова време, когато се поддържа за сред силно мода атома става невъзможно и разрушаването на кристалната решетка започва от тази точка, в резултат на затихване и за далечни разстояния. А твърди стопилки.
В аморфни твърди вещества с времето на промяна на температурата не е постоянна температура част А, и само на точка на инфлексия. Увеличаването на аморфна телесна температура, придружено от постоянно намаляване на вискозитета му.
Обратните трансфер на вещество в твърдо състояние е възможно от двете течни и газообразни състояния. В този и в другия случай преход настъпва от състояние лишен на симетрия, в състоянието, където съществува симетрия (това се отнася за реда на далечни разстояния, което се случва в кристали и в която не течности или газове). Следователно, преходът към твърдо състояние трябва да се появят внезапно при определена температура, за разлика от преминаването на течността пара, която може да се проведе непрекъснато. Процесът на образуване на твърдо тяло с охлаждаща течност е процес на образуване на кристали (кристализация) и се среща при определена температура - температура на кристализация. Тъй като за такава система конверсия, енергийните намалява, този преход трябва да бъде придружено от освобождаването на енергия под формата на топлина на кристализация. Законът за запазване на енергията следва, че топлина на топене и топлина на кристализация е равна на една от друга.
Свързани статии
