Окислението на сулфиди кислород във въздуха - необратим екзотермична реакция:
MeS + 1,5O2 = MeO + SO2.
При нагряване на въздух до сулфид достигане на определена температура скоростта на реакцията става толкова голям, че отделеният топлината не само за да се компенсира загубата на топлина в околната среда е достатъчно, но също така и да се повиши температурата на окисляем сулфид, което допълнително ускорява окислителната реакция. Та температурата, над която процеса на окисление може да се осъществи независимо без доставяне на топлина отвън, той се нарича температура на запалване сулфид. Тази температура зависи от вида на сулфид и размера на зърното, както и по-висока сулфид дисоциация с по-висока еластичност е по-ниска от по-ниските сулфидите с ниска еластичност дисоциация.
Скоростта на окисляването на сулфида твърдо вещество кислород във въздуха определя от условията на дифузия на газове през утайката от твърди реакционни продукти, покритието все още непроменени сулфид в централната част на зърното. Реакцията протича на границата на твърди фази - метален сулфид и твърд реакционен продукт - метален оксид слой, чрез който кислород преминава навътре и към него - серен диоксид. Тъй като скоростта на предварително сулфид окислителната реакция предната се забавя, тъй като условията на кислород и отстраняване на серен диоксид чрез кората сгъсти постепенно се влошава оксиди. Времето, необходимо за пълно окисление на сулфид нараства зърна силно с увеличаване на размера на зърното.
Увеличаването на температурата над определена граница в много случаи понижава степента на окисление, ако температурата се повишава тюлени - синтероване кори оксиди уврежда дифузия. При окисляването на желязо температура сулфид покачване над 900 ° забавя окисление, тъй като над 900 ° съществува силна уплътнение кори железни оксиди.
Окислението на сулфиди с атмосферен кислород е основна реакция синтероване обработва серни материали с цел частично или пълно отстраняване на сулфид сяра. Понастоящем подлага само на печене дребнозърнест прахове. Флотационни концентрати са сравнително фина до бързо окисляване; компактни сулфидни материали като Feinstein, фино смлени преди изпичане.
Старият начин на изпичане е да се окисли кислорода от дебелината на прах слой въздух легнало 50-100 mm на пещ огнище. Тъй като само достатъчно бързо окислен слой върху повърхността на частиците, материалът peregrebaetsya специален механизъм, като по този начин за постигане на отнемане на дълбочина на повърхностния слой е не-окисляващи сулфидни частици, както се движи напред материал настоящите газове на пещта. Печенето на огнището е бавна, тромава оборудване и непродуктивен. За пълното отстраняване на сярата от суровината трябва да бъде отработено гориво поради големия загубата на топлина.
Нови интензивни процеси на окисляване изпичане се извършва така, че всяко зърно суровини по време на изпичане е в потока от горещ газ, съдържащ кислород. Това създава благоприятни условия за доставка на кислород и отстраняване на SO2 чрез утайка от твърди зърна сулфид окислителни продукти и процесът протича при максимална скорост.
По време на изпичане суспендира сух сулфид концентрат се пулверизира дюза въздух в кухината на пещта с нагретите стените.
При удар в кипящ слой с нажежаема жичка с дебелина (500-1000 mm) прах изгори материал на огнището на пещта непрекъснато се продухва с въздух през множество малки отвори с диаметър 2 mm в огнището. На струи въздух прониква в слоя от изгорелия материал, създават него интензивно вихрообразно потоци придаване тип слой кипяща течност. Прясно концентрат се подава непрекъснато в кипящ слой, и Калцинираният продукт непрекъснато се прехвърля през прага на пещта, ограничаване на височината на кипящия слой.
Интензивен техники за печене със суровини, богати на сяра, които не се нуждаят от трета страна на гориво и произвеждат SO2 богати газове. Голяма част от продукта при тези условия калциниране, увлича газове под формата на прах, за който да се използва за улавяне система отстраняване високо прах.
Калциниране на оловен сулфид материали с излишък на въздух, така че печене газ продуктът съдържа, заедно с SO2 и N2, значително количество кислород. Кислородът окислява SO2 до серен триокис чрез реакция SO2 + 1 / 2O2 = SO3. Тази реакция е в основата на процеса на сярна киселина контакт. Равновесната константа на реакцията на дисоциация на серен анхидрид
определя с много висока точност.
KSO2 числени стойности са дадени по-долу:
Тези стойности показват, KSO2 SO3 ниска якост при високи температури. Според правило SO3 дисоциация Льо Шателие се увеличава с намаляване на налягането. Това е от съществено значение за процеса на изгаряне, при парциалното налягане SO3 в газове на пещта не е по-висока от 0.1 атм.
SO3 силно инхибира реакцията синтез при ниски температури. катализатор платина в производството на сярна киселина предизвиква образуването на SO3 при 400 °, Fe2O3 ефективно каталитично действие при 600 °.
Съставът на газовете пещ при изпичане сулфиди варира с температурата поради образуването и разлагането на SO3. Ако газът в началото на образуването имаше SO3 SO2 и O2 частични налягания съответно PSO3 и РО2, след това се дължи на образуването на SO3 с PSO3 налягане на SO2 и намаляване парциално налягане O2. Те стават равни pSO2 = PSO3 - pSO3. и РО2 = РО2 - 1 / 2pSO3, тъй като образуването на SO3 мол изразходвано мол SO2 и половин мол O2. За SO2 налягане на равновесие система, SO3 и O2 са свързани с експресията KSO3, което позволява да се изчисли налягането на SO3 газ в пещта (pSO3) PG, както е разтвор на следното уравнение по отношение pSO3.
Наличието на SO3 в печене газове по време на изпичането причинява образуването на сулфиди сулфати на метални оксиди.
Получените сулфатите са доста стабилни в окисляваща атмосфера и може да се движи в крайната свещта. В някои случаи е желателно, ако целта е общо отстраняване печене сяра, в други случаи - по време на изпичане за последващо хидрометалургична обработка - образуването на сулфати полезни. Въпросът за условия на образуване и разграждане на сулфат по време на изпичане може да бъде решен, ако има термодинамичните характеристики сулфати.
Характерното количество може да служи сулфат (# 916; Z0T) изображение сулфат метален окис и серен анхидрид съгласно реакцията
(Оксид) секунда + (SO3) газ = (сулфат) ароматна,
посочен един мол SO3 изразходвани.
Фиг. 45 показва графики на температурната зависимост на (# 916; Z0T) изображение на различни сулфати с криви (# 916; Z0T) изображение на SO2 и SO3 от 1 мол на реакционния продукт.
Реакционната образуване сулфат Уравнение определя форма експресия дисоциационната константа на равновесие на реакционната Ksulf сулфат. = PSO2 стойност (# 916; Z0T) сулфо - цифровата стойност на тази постоянна:
Стойност (# 916; Z0T) Ksulf сулфит и характеризиране сила химична връзка с SO3 оксид - сила сулфат. Колкото по-голяма стойност на тези количества, по-малко сила сулфат.
Имайки графиките (фиг. 45), може да се отбележи, че силата на увеличенията сулфат с основните свойства на оксид образуване сулфат. Най-стабилната форма сулфати, метални оксиди на алкални, сулфати, оксиди са по-силни калциеви и бариеви сулфати са още по-малко трайни бивалентни тежки метали и най-нестабилните сулфати образувани Al2Oz амфотерни оксиди, Fe2O3.
С характеристиките и състава на сулфатни газове на пещта може да реши проблема на възможността или невъзможността за формиране сулфат, както и решаване на проблема на дисоциация в присъствие на съединения на продуктите за дисоциация. Образуването на сулфат е възможно, ако налягане газообразен SO3 сулфат дисоциация продукт в атмосфера на пещта газове над оксид е по-голяма или равна SO3 налягане разработена по време на дисоциация сулфат.
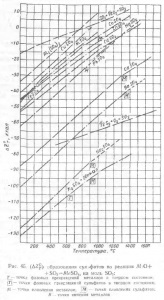
Сулфат, образуван ако (pSO3) PG> (rSO3) сулфит, в противен случай е невъзможно да формация сулфат, и вече образуван сулфат да се разложи.
Практика изпичане установено, че образуването на сулфати предпочитан от високо съдържание на SO2 в калциниране и нискотемпературни продукти. образуване сулфати по време на изпичане се наблюдава при температури 500-650 °.
Когато стрелят е невъзможно да се избегне образуването на сулфати, както е определено в етапа на изгаряне ще бъде в полза на условия сулфатизация. Ако калциниране продукт не трябва да бъде сяра, предварително образувани сулфати трябва да бъде разрушен повишаване на температурата. Ако температурата на горене се увеличава, така че (pSO3) PG става по-малка (rSO3) сулфо, допълнително образуване на сулфат се прекратява и вече образуван сулфат разлага бавно с отделяне на SO3. необходимо за повишаване на температурата, така бързо и пълно унищожаване на сулфат на налягането на газообразния дисоциация продукти сулфат надвишава външното налягане.
Дисоциацията сулфат на оксид и SO3 се придружава от значително дисоциация на SO2 и SO3 в процеса на кислород дисоциация и е описано в следната реакционна уравнение:
и налягането на реакционните продукти се състои от налягане SO3, SO2 и О2:
Размер = Ksulf rSO3 дава само един от компонентите Rsulf - SO3 налягане. При температури забележимо разлагане трайни сулфати pSO3 величина представлява само една малка дълго общо налягане на реакционните продукти са силно дисоциирани SO3 на SO2 и O2.
дисоциация налягане продукти сулфат SO3, SO2 и O2 са взаимосвързани експресия KSO3 и SO2 и O2 налягане - съотношение PO2 = 1 / 2pSO2, тъй като тези газове са изключени SO3 разлагане. С количества Ksulf KSO3 и за определена температура и се използва по-горе отношенията между количествата pSO3, pSO2 и РО2, може да се изчисли общата величина на налягането на газа при дисоциацията на формула сулфат
Температурата, при която Rsulf достига 1 атм наречен сулфат температура разлагане. Отоплителни угарки - калцинира до тази температура позволява бързо и пълно разлагане на предварително образуван сулфат.
Количеството Psulf лесно да се определи експериментално чрез директно измерване налягане сулфат дисоциационните продукти. Големината и размера Rsulf KSO3 може да се изчисли на парциалното налягане на SO3, SO2 и О2, т. Е. да се намери на експерименталните данни дисоциационна константа Ksulf сулфат. В продължение на много сулфати са експерименталните данни за зависимостта на температурата на Rsulf.
сулфат температура разлагане и под температурата, при която сулфат pSO3 стойност на дисоциация достига 1 атм. . В графиките (Фигура 45.) Най-голямата pSO3 = 1 атм съответства на температурата, при която (# 916; Z0T) сулфат изображение е нула. Например, (# 916; Z0T) изображение CdSO4 нула при 1440 ° и -PCdSO4 = 1 атмосфера при 1060 °; (# 916; Z0T) изображение NiSO4 нула при 1050 ° и PNiSO4 = 1 атмосфера при 890 ° С. Оттук и необходимостта от включване сулфат SO3 дисоциация на изчисления поведение; неспазване на това състояние води до големи грешки при определяне сулфат температурата на разлагане, по-голям, колкото по-високо съдържание на сулфат.
сулфат температура разлагане намалява ако сулфат се разлага в присъствието на нелетлив киселинен оксид разрешаване твърд оксид съединение с метален сулфат. Например, в присъствието на силикагел калциев сулфат се разлага чрез взаимодействие на
CaSO4 + SiO2 = CaSiO3 + SO3.
При тези условия (# 916; Z0T) реакции на разпадане CaSO4 включващи ZSiO2 по-малко (# 916; Z0T) CaSO4 реакция разлагане без участие SiO2 от количество (D2 °) реакционни CaSiOs разлагане в CaO и SiO2. От това следва, че действието на ZSiO2 за дисоцииране SO3 CaSO4 придружен от повишено налягане, и следователно, температурата се понижава сулфат разлагане.
При разширяване на ниски оксиди на метални сулфати, също образуващ горната оксид, сулфат реакция разлагане се усложнява от окисляване на долния метален оксид. Например, реакцията на разлагане 2FeSO4 = Fe2O3 + SO3 + SO2 придружава от окисляването на Fe2O3 до FeO.
Здравото сребърен сулфат Ag2SO4 дисоциира съгласно реакцията Ag2SO4 = 2ag + SO3 + 1 / 2O2 с едновременно разлагане на нестабилни компоненти оксид Ag2O на сребро.
В тези случаи стойността (# 916; Z0T) реакция не съвпада с (# 916; Z0T) сулфат имидж и трябва да бъдат проектирани с помощта на термодинамичните функции, характерни за новите продукти на процеса.
Разбира се, в случаите, описан сложни реакции на разлагане на сулфати да се изчисли необходимото количество Rsulf сулфат и температурата на разлагане да се помисли за дисоциацията на SO3 на SO2 и O2.
Образувани между сулфати и сулфиди неизменно възможно странична реакция на окисление на сулфид с кислородни сулфати, например ZnS + 3ZnSO4 = 4ZnO + 4SO2 и образуване на метал, такъв като PBS + PbSO4 = 2Rb + 2SO2.
При намаляване на сулфати газообразни и твърди редуциращи агенти могат да бъдат получени по различни продукти в зависимост от вида на сулфат и температура. Трайни сулфати Na2SO4, CaSO4, BaSO 4 по бавно възстановяване запазват всички сяра, обръщайки се към сулфиди чрез взаимодействие на CaSO4 + 4CO = CAS + 4SO.
Разлагането на химични съединения с пълно отстраняване на летливите компоненти е задача на един от видовете процес калциниране калциниране, който се използва за СаО на варовик, MgO от магнезит, Al2O3 алуминий от алуминиев хидроксид и др. N. В пещи за калциниране на материал се нагрява до бързо температура на разлагане съответните съединения: карбонати, хидрати и след калциниране на продукта се охлажда.
Разграждане съединения (карбонат хидрат) в поток от пещта газове е възможно, ако налягането на съединение газообразен продукт на дисоциация (CO2, H2O) става по-голямо от парциалното налягане на същия продукт в газове на пещта. Въпреки това, до налягане остава дисоциация съединение продукт по-малко от общото налягане на атмосферата на пещта, скоростта на дисоциация е ниска и зависи от условията на дифузия на продуктите за дисоциация в атмосферата на пещта газове. При нагряване до температура, при която налягането на дисоциация продукти газообразни е равно или по-голямо от налягането на атмосферата на пещта, скоростта на процес не зависи от дифузия на фактори и се определя само от скоростта на въвеждане на топлина, необходима за ендотермичната дисоциацията на съединението.
Температурата, при която газообразно съединение дисоциация продукти налягане достига 1 атм, наречен температура разлагане на съединението. За разлика от карбонатите и сулфатите на хидрат дисоциация продукт се състои почти изцяло от CO2 или H2O, тъй като тези стабилни съединения не са значително dissitsiruyut неговите компоненти при температури на изпичане.
На практика изпичане се извършва в вала на калциниране и отражателни пещи, т. Е. при атмосферно налягане. температурата на калциниране трябва да е над температурата на разлагане на съответните съединения - карбонат или хидроксид.
При това условие, калцинирането може да бъде подложен на бучки материал. продължителност на процеса трябва да бъде достатъчна за нагряване на цялата маса на детайла до температурата на разлагане на съответните съединения.
Свързани статии
