От всички общи течна вода - най-течност гъвкав разтворител с максимални стойности на повърхностното напрежение, диелектрична константа, и висока температура на изпарение (след амоняк) на топлина на стапяне. За разлика от много вещества, вода, замразяване при ниско налягане, се разширява.
Тези специфични свойства на водата са свързани с специална структура на молекулите. Химична формула Н2 0 вода привидно проста. вода молекулни водородни атоми на ядрото са разположени асиметрично по отношение на ядрото на кислороден атом и електрони. Ако кислородният атом е в центъра на тетраедър, центровете на масата на два водородни атоми са в ъглите на тетраедър, и центровете за зареждане на два електронни двойки заемат другите две ъгли (фигура 1.1). По този начин, четири електрони са разположени на възможно най-голямо разстояние както от кислороден атом на ядрото, и ядрата на водородните атоми на които са изготвени ядро кислороден атом. Други шест водни молекули електрони са подредени така, четири електрони са в състояние да предоставят химична връзка между ядрата на кислород и водородни атоми, а другите две са разположени в близост до ядрото на кислородния атом.
Асиметричното подреждането на атомите на молекулата на водата предизвиква неравномерно разпределение на електрически заряди в него, като полярна молекула вода. Такава структура на молекулата на водата причинява водни молекули привличането помежду си в резултат на образуването на водородни връзки между тях. Местоположение водородните и кислородни атоми във водните молекули образуват агрегати, подобни на подреждането на силициеви и кислородни атоми в кварц. Това се отнася до лед и най-малко една течна водна молекула агрегати, които са винаги в етапа на преразпределение. При охлаждане, водните молекули са групирани в своите агрегати, които постепенно се увеличава и да станат по-устойчиви, тъй като се доближава до температура от 4 ° С, когато водата достигне своята максимална плътност. При тази температура, водата все още има твърда структура, и заедно с неговите дълговерижни молекули, има голям брой индивидуални водни молекули. С допълнителни охлаждащи вериги вода молекули растат чрез прибавяне към него на свободни молекули, при което плътността на вода намалява. Когато водата се превръща в лед, всички молекули са повече или по-малко твърда структура под формата на отделни затворени вериги образуващи кристали.
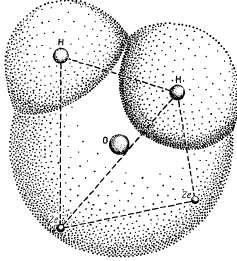
Взаимното проникване на водородните и кислородни атоми. Ядрата на два водородни атома и две двойки електрони са в ъглите на тетраедър: в центъра на ядрото кислороден атом.
Високите стойности на повърхностното напрежение и топлина на изпарение на вода се дължи на факта, че водните молекули са разделени от групата на молекули изисква относително голям разход на енергия. Желанието на водни молекули за установяване на водородно свързване и полярност обясни необичайно висока разтворимост във вода. Някои съединения, такива като захари и алкохоли, се запазват в разтвора поради водородни връзки. Съединения, които имат висока степен на йонизация на входа, като натриев хлорид, се запазват в разтвора се дължи на факта, че йоните се неутрализира чрез противоположно заредени групи ориентирани водни молекули.
Молекулата на вода Н2 О конструирана като триъгълник ъгъл между две връзки кислород - H 104 градуса. Но тъй като два водородни атоми са на една и съща страна на кислород, електрическите заряди са диспергирани в него. Полярен вода молекула, която е причина за много взаимодействие между различните го молекули.
Водородните атоми в молекулата на Н2 О, имащи частична положителен заряд, взаимодействат с електроните на кислородните атоми на съседни молекули. Тази химична връзка нарича водород. Тя обединява молекулите Н 2О в оригиналната пространствената структура на полимери; равнина, в която водородните връзки са разположени перпендикулярно на равнината на атомите в същата молекула Н2 О. взаимодействието между водните молекули и обяснява главно с неправилна висока точка на топене и неговата точка на кипене. Ние трябва да донесе допълнителна енергия да подкопае и след това да унищожи водородните връзки. И тази енергия е много значима. Ето защо той е висок топлинен капацитет на водата.
Както при повечето вещества, вода се състои от молекули и атоми на миналото.
атом следната структура: около положително заредена протон ядрото на определени нива в различни орбити движат отрицателно заредени електрони, които са електронен облак. Броят на електрони във всяка черупка е строго определено за всеки елемент на атома. По този начин, водороден атом, само един пакет с един електрон и кислороден атом, две черупки: вътрешната и два външни електрони шест.
Два водородни атома са заместени с два позиция липсва (до осем) на външните електрони обвивка за неговата стабилност. Един ще приемем, че кислородният атом и два водородни атоми в една молекула вода форма на централно кислороден атом на ъгъл близо до 180 °. Въпреки това, в действителност е много по-малък - само 104 ° 27 '(фигура 1.2), което води до непълни компенсация вътрешномолекулни сили, които причиняват асиметрия излишък разпределяне на шихтата, което създава полярността на водните молекули. Тази полярност на водата, по-голямо от това на други вещества, предизвиква неговото диполен момент и диелектрична константа. Последното е много високо съдържание на вода и определя интензитета на водата на разтваряне на различни вещества. При 0 ° С диелектрична константа на вода (твърда фаза) е 74.6; намалява с повишаване на температурата.
Така например, при 20 ° C. диелектрична константа на водата се 81. Какво означава това? Това означава, че две противоположни електрически заряд във вода са взаимно привлечени със сила равна на
1/80 от взаимодействието им във въздуха, и че разделянето на йони от кристалите на сол във вода до 80 пъти по-лек от въздуха.
Многобройни структура верига на водните молекули са хипотетични конструирана на непреки наблюдения устройства някои признаци на поведение и свойства на молекули и атоми. Трябва да се помни, че не атоми или молекули, не разполагат с ясни граници, поради несигурността на формата и на точните размери на орбитите, в който електроните се движат, образувайки всъщност електронен облак, в зависимост от състоянието на енергия на електрон. Последното може да бъде възбуден и комфорт, който зависи в частност от температурата. Следователно несъответствие в изчислените стойности на радиуси, както и схематични хипотетични модели на атоми и молекули.
Свързани статии
