При образуването на момент и свойствата на комплекси на съединенията е обяснено по отношение на теорията на метода на валентните връзки на (Британска Колумбия), теория кристал поле (TST) и теорията на молекулно орбитален (МО).
По-долу накратко някои примери за всяка от теориите.
Теорията на метода на валентните връзки
Амфибия теория счита образуването на комплексни йони като донор-акцептор взаимодействие на несподелени електронни двойки и свободен лиганд орбитали комплексообразуващ агент.
Разглеждане на комплекс йон [Co (NH3) 6] 3+
2 1s 2s 2p 2 6 2 3s 4s 3P 6 0 6 4P 3d 4d 0 0
В съответствие с член Hund електроните в нивото на външната енергийна подредени както следва:
Комплексообразувател има координация номер КН = 6, 6 могат следователно да придават лиганди всяка от които има един неразделен двойка електрони, и, следователно, донор на електрони. Акцептор (комплексообразуващ), за да побере шест двойки електрони трябва да осигури шест свободни орбити. При образуването на комплекс йон [Co (NH3) 6] 3+ четири несдвоен електрон в D - Co 3+ първо състояние форма електронни двойки, при което двете 3D-орбитали освободени:
Тогава той формира комплекс йон [Co (NH3) 6] 3+. със следната структура:
При образуването на комплекс йон участват интериор 3d-орбиталния и външната 4S- и 4P-орбити. тип хибридизация - d2sp3.
Като само сдвоени електрони казва диамагнитно йон.
Crystal теория на полето
Кристал поле теоретичната стойност въз основа на предположението, че връзката между комплексообразуващ лиганд и частично йонен. Въпреки това, като се вземе предвид влиянието на електростатично поле на лиганди на енергия състоянието на електроните на централния йон.
К2 [Zn (CN) 4] - има четиристенен пространствена структура (sp3 - хибридизация)
К3 [Fe (CN) 6] - има осмостенно пространствена структура (sp3d2 хибридизация)
Комплексообразуващи агенти имат следната електронна конфигурация:
г - електрони от същата енергия нивото на същите в случай на свободен атом или йон. Но действията на електростатично поле лигандите насърчава разделянето на енергийните нива на г - орбитали на централната йон. И разделянето на повече (в една и съща комплексирането), толкова по-силен областта произведени от лигандите. В тяхната способност да предизвика разделяне на енергийните нива на лиганди, подредени в един ред:
CN -> NO2 -> NH3> SCN -> Н2 О> OH -> F -> Cl -> Br -> I -
Структурата на комплекс йон засяга характера на разделянето на енергийните нива на комплексообразуващ агент.
В осмостенно структура на комплекс йон, dγ орбитали (DZ 2 -, DX 2 -Y 2 орбитали) са подложени на силни поле лиганд взаимодействия. и електроните на тези орбитали може да имат по-висока енергия, отколкото електроните dε орбитална (dxy dxz, dyz -. орбитали).
Разделянето на енергийните нива за електроните в областта осмостенно лиганд на г състояние може да бъде представен от схемата:
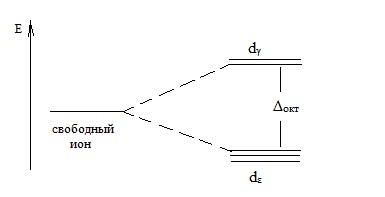
Тук Δokt - разделяне на енергия в поле осмостенна лиганд.
В тетраедални координация комплекс йонна dγ орбитали имат по-ниска енергия от орбиталната dε:
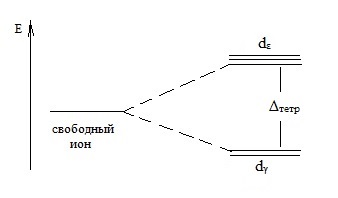
Тук Δtetr - разделяне на енергия в поле четиристенна лиганд.
Енергия разделяне делта експериментално определена от спектрите абсорбиране на светлина кванти вещество, чиято енергия е равна на енергията, съответстваща електронни преходи. Абсорбция спектър, както и оцветители и комплексни съединения на г-елементи, поради електрон преход от г-орбиталния на най-ниската енергийна г-орбиталния на по-висока енергия.
По този начин, в случай на соли на K3 [Fe (CN) 6], абсорбцията на светлината кванти, вероятно преход на електрон от орбитален dε dγ за орбитално. Това обяснява, че солта е с оранжево-червен цвят. Сол на К2 [Zn (CN) 4] не може да абсорбира светлина и, следователно, е безцветен. Това се дължи на факта, че прехвърлянето на електрони с орбитален dγ на dε орбитална практически невъзможно.
Молекулно орбитален теория
С този метод, високо завъртане електронен конфигурация изобразяват комплекс йон [Ni (NH3) 6] 2+.
Електронната конфигурация на Ni2 + йон:
1s 2 2s 2 2p 6 3s 3P 6 4s 2 0 3d 8 4P 0 4d 0 или 0 ... 4s 3d 8 4P 0 4d 0
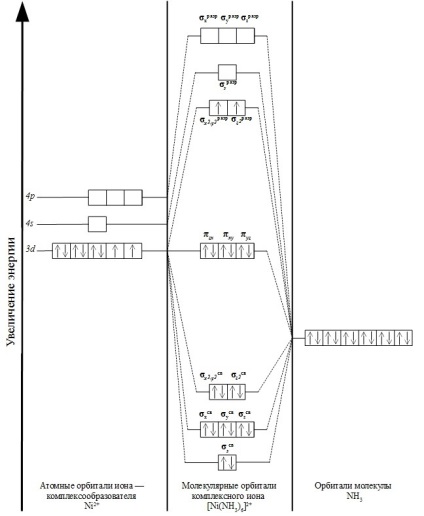
Комплексът йон [Ni (NH3) 6] 2+ в образуването на химични връзки са включени централната 8 Ni2 + йон и електрони 12 електрони шест NH3 лиганди.
Комплекс йон има осмостенно структура. MO образование е възможно само в случаите, когато първоначалната енергия на взаимодействащите частици са по-близо в техните стойности, както и ориентирани в пространството по съответния начин.
В този случай, орбиталните 4s Ni2 + йон еквивалентни орбитали припокрива с всеки от шестте лиганди. В резултат на молекулни орбитали формира: σs свързващи комуникация и antibonding освобождаване σs.
Припокриване три 4P-орбитали орбитали комплексообразуващи лиганди води до образуването на шест σp-орбитали: свързване σh комуникация. σy комуникация. σz свързване и дезинтегриращи σh разряд. σy разряд. σz разряд.
Припокриване DZ 2 и DX 2-ил 2 комплексообразуващи лиганди орбитали насърчава образуването на четири молекулни орбитали: две свързващи σ х 2-ил комуникация 2. σ Z 2 свързване и σ antibonding два бита х 2 - у 2. σ 2 Z бита.
Орбитали dxy. dxz, dyz Ni2 + йон не се свързва с орбитите на лиганд, като не насочени към тях. Поради това, че не участват в образуването на σ-връзка и са необвързващи орбитали: πxz. πxy. πyz.
Общо комплекс йон [Ni (NH3) 6] 2+ съдържа 15 молекулни орбитали. Местоположение електроните могат да бъдат представени, както следва:
Схематично, формирането на молекулни орбитали, показани в схемата по-долу:
Свързани статии
