4.Spinovoe квантово число. обозначени (MS), тя не е свързана с характеристиката на атомна орбитала и условно характеризират електрон собствена въртене около оста си; това може да отнеме само две стойности: +1/2 и -1/2, различаващи се една от друга, както и стойностите на другите квантови числа за единица.
Първите три квантови числа характеризират орбитални, който е на електрона; четвъртото квантово число описва поведението на електрон в тази орбитална.
Общи характеристики на електрона в много-електронна атом се управлява от принцип, който е формулиран в 1925 от Волфганг Паули (1900-1958).
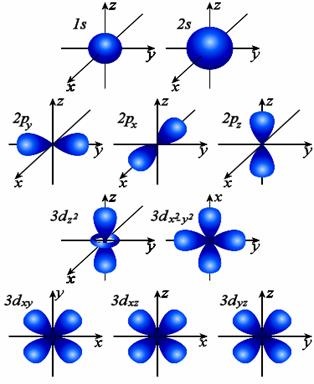
Фиг. 1. форма и ориентация в пространството на 1S електронните облаци -, 2S-, 2p - и 3d - орбитали
в един атом не може да бъде два електрона със същите квантови числа.
Това означава, че в орбита характеризира с три квантови числа не може да бъде повече от два електрона. Две електрони са в същото орбитала различават един от друг по размер броя на въртене, т.е. характеризиращ се с обратното, или антипаралелни завъртания и наречена сдвоени. Тази електронна двойка, разположени на същите орбитални схематично изобразени противоположно насочени стрелките, докато единната, т.е. свободен електрон във всяка орбитална представлява от една стрелка.
Един електрон в атома има тенденция да се осъществи с най-ниско енергийно съдържание.
Енергийният изгодно място в атома позволява принцип Aufbau:
енергичен предимство на пространство определя от най-малката сума от номерата на основната и страничната квантовата (п + L), ако тази сума е същото, електроните се пълнят с по-малко поднива п.
Въз основа на правилата Klechkovskii, електроните ще запълнят поднива в следната последователност:
1s 2 2s 2 2p 6 3s 3P 2 6 2 4s 3d 4P 10 6 2 4d 10 5s 5р 6s 2 4f 6 5d 14 10 6 6p 7s 2 5f 6d 14 10 14 6f 7P 6
Пример 12. Запис 18 имейл формула Ar атома. Определяне на броя на нивата, поднива, валентни електрони.
Запис: д 18 атомна формула Аг
1.Iskhodya Aufbau принцип на електрони ще запълни поднива в следната последователност: 1s 2s 2 2 2 2p 6 3s 3P 6 (д формула Ar атоми).
нива 2.Number атом в Аг - 3.
3.Podurovni атом Аг - (S, Р).
брой на електрони 18 AH 1s 2s 2 2 2 2p, 3p 3s 6 6. валентните електрони: 3s 3P 2 6.
Отговор: формула Е-2 18 AH 1s 2s 2 2p 6 3s 3P 6. 2 на броя нива в Аг атом - 3; S-, р-поднива валентните електрони: 3s 3P 2 6.
Попълване орбиталните електрони в рамките на един подниво се извършва в съответствие с правилата Gunda.
Първо правило Gunda. в това подниво електроните са склонни да запълни енергийни състояния, така че общото въртене е минимизиран.
Второ правило Gunda. Той има най-ниското енергийно състояние с максимален размер на магнитни квантово число.
Съгласно химична връзка се отнася до различни видове взаимодействия, което води до стабилна наличието на ди- и поливалентни съединения: молекули, йони и други кристални материали.
химичната връзка, образувана от двойки електрони споделени от два атома се нарича ковалентна връзка.
За да се опише момента химични връзки са най-широко използваните poduempiricheskie опростени методи - метод на валентните връзки (МВС) и метода на молекулни орбитали (MMO). В основата на тези методи са представяния на квантовата механика.
MBC подсказва. че взаимодействието между атоми се извършва само от несдвоени електрони.
Основните разпоредби на МВС:
а) химичната връзка между двата атома се появява в резултат на припокриване AO да образуват двойки електрони;
б) атоми, влизат в химична връзка, се обменят между електроните, които образуват свързващи двойки. Обмяна на енергия на електроните между атомите (привличане енергийни атома) прави основен принос за енергията на химична връзка. Допълнителна принос към свързващата енергия на силите на взаимодействие Кулон получаване на частиците;
в) в съответствие с Pauli принцип химична връзка се образува само във взаимодействието на електрони с противоположни завъртания;
характеристики ж) химично свързване (енергия, дължина, полярност, и т.н.), определени от вида на припокриване AO.
Общите електронни двойки могат да бъдат получени:
а) на механизма за обмен;
б) механизъм донор-акцептор.
Exchange механизъм - общата електронна двойка, образувана от несдвоен електрон на взаимодействащите атоми.
По този начин, образуването на Н2 молекули. Cl2 може да бъде представена както следва:
Схема 1. Електронна схема H2 молекули. Cl2
При образуването на електронна двойка брой електрони във външния слой увеличава двата атома.
За по-опростена и по-интуитивна схема употреба валентност запис. в която всяка двойка е обозначен с общото електронно табло.
Ако образуването на молекула използва образуване на връзка само обмен механизъм, валентност диаграма на същата форма със съединението със структурна формула.
механизъм донор-акцептор - връзката е образувана от една електронна двойка атоми и други свободни орбити.
Така общата валентността на елемента е равен на броя на несдвоени електрони (обмен механизъм) и броя на връзки, образувани в механизма на донор-акцептор.
В зависимост от характера на припокриването на електрона облаци отличават # 963; - (Sigma -), π - (PI) и # 948 - (делта) връзка (Фигура 2).
Sigma-комуникация (# 963) -връзките. AO образува чрез припокриване на линия, свързваща ядрата (Фигура 3).
# 963; може да възникне, когато -връзките припокриващи и орбитали, S- и р орбитали, стр орбитали, D орбитали, D - и S орбитали, D- и р орбитали и F орбитали един от друг, и с припокриване на хибридни орбити.
Бонд, образуван от припокриването на г орбитали всичките четири листенца, наречени # 948; -Контрол на достъпа (фиг. 5).
Фигура 5. области на припокриване на атомните г орбитите,
Свойства на ковалентната връзка
1.Napravlennost ковалентна връзка. Ориентация на комуникация се определя от типа на хибридизация АД. Образуването на ковалентни връзки се очаква да участват не само "чисти" атомни орбитали (AO), но също и "смесени", така наречените хибридни, АД. Когато хибридизация оригиналната форма и енергийни орбитали (електронни облаци) са взаимно променени и формира орбитални (облаци) нов същата форма и същата енергия. Броят на хибридни орбитали (р) е броят на източника. Молекулите структура AB тип в зависимост от вида на хибридизация са показани в таблица. 6.
Ако хибридизация включва един s- и р-орбитали он (SP-хибридизация-ТА), образувани две еквивалентни SP-орбитите; един от двата S- и р-орбитите (SP 2 хибридизация) са оформени три SP 2 орбитали, и т.н.
Хибридни облак, съответстващо на определен вид на хибридизация, са разположени в един атом така, че взаимодействието между електроните е сведена до минимум, т.е. доколкото е възможно, от друга. Ето защо, в SP-хибридизацията на електронните облаци са ориентирани в противоположни посоки. Когато SP 2 -hybridization - в посоки лежи в една равнина и представлява заедно ъгъл от 120 ° (т.е. в посока към върховете на равностранен триъгълник) в SP 3 -hybridization - до върховете на тетраедър (ъгъла между тези посоки е 109 ° 28 '), с SP 3 хибридизация г 2 - към върховете на един октаедър (т.е., по взаимно перпендикулярни посоки).
Количествено, ориентацията се изразява като връзката ъгли между посоките на химически връзки в молекули и твърди вещества.
2.Nasyschaemost ковалентна връзка е причинена от ограничаване на броя на електроните в външни черупки, които могат да участват в образуването на ковалентна връзка. Например, един електрон от водород, следователно, една връзка. Поради това е възможно H2. но не H3.
3.Polyarnost ковалентна връзка. Ако ковалентна връзка се формира от едни и същи атоми, например Н-Н, О = О, Ci-CI, N≡N, споделените електроните равномерно разпределени между тях.
Такава връзка се нарича неполярна ковалентна връзка. Ако един или повече атоми привлича електрони, електронната двойка измества към този атом. В този случай, полярен ковалентна връзка.
Поради изместването на електронна двойка една от сърцевини, повишава плътността на отрицателен заряд в даден атом и съответно получава заряд атом, наречена ефективна заряд атом # 948; -. Вторият атом е повишен положителен заряд плътност # 948; +.
Обем на електроните и полярността на връзката е по-голяма, толкова по-голяма разликата в електроотрицателност на взаимодействащи елементи.
Свързани статии
