Катедра по акушерство и гинекология
Прекратяване на кървене след травматично увреждане на кръвоносните съдове се нарича хемостаза.
Има четири фази на хемостаза:
· Първата фаза - намаляването на повредения кораб. Това намалява притока на кръв към дистално от зоната на травма.
· Втори етап - формиране на мястото на нараняване хлабав щепсел тромбоцитите или бял тромб. Търговски част е повреден колаген свързващо място за тромбоцити; последният в резултат на свързването на вътрешната си структура се разрушава и се освобождава тромбоксан и ADP. Това от своя страна индуцира нова тромбоцитите придържане и по този начин се образува хлабав временно щепсел. Продължителността на тази фаза се определя от хемостаза на кървене продължителност.
· Трета фаза - формиране червен тромб (кръвен съсирек).
· Четвърта фаза - частично или пълно разтваряне на съсирек.
Има три вида на тромби или съсиреци:
· Бял кръвен съсирек (първи тип) е оформен от тромбоцити и фибрин; има сравнително малко червени кръвни клетки. Той е оформен в областта на увреждане или болестно стена съд в условия на висока скорост на потока (в артериите).
· Вторият тип на кръвни съсиреци - се разпространява отлагане на фибрин в много малките кръвоносни съдове (капиляри).
· Третият тип на кръвни съсиреци - червени кръвни съсиреци - се състои от червените кръвни клетки и фибрин. Морфологията на червените кръвни съсирек подобен на морфологията на съсиреци, образувани ин витро. Червените кръвни съсиреци се формират ин виво в области на бавно притока на кръв в отсъствието на патологични промени в съдовата стена в мястото на увреждане или променени съдовата стена след започване на тромбоцитите щепсел.
- Започване на образуването на тромби в отговор на тъканно увреждане се извършва чрез външния път на коагулацията.
- Започване на образуването на тромби в червените кръвни забавено или анормален стена съд в отсъствието на тъканно увреждане настъпва чрез вътрешния път на коагулационната.
- Външна и вътрешна коагулация път приключи до окончателното-често срещаните. На този етап има преход на протромбина в тромбин и тромбин-катализираната превръщането на фибриногена във фибрин съсирек.
Таблица 1. Системата на номериране на фактори на кръвосъсирването.
Стаите не отразяват последователността фактори
Превръщането на фибриногена във фибрин, тромбин-катализираната
Фибриноген (фактор I. Виж фигура 1 и таблица 1, ...) - е разтворим плазмен гликопротеин, синтезиран в черния дроб, молекула си дължина е 46 пМ, моларна маса 340000. молекула съставена от шест полипептидни вериги (две A # 945; - верига две B # 946; вериги и две # 947; веригата). Структура на фибриноген - A # 945; 2 946 # 2 # 947; 2. В # 946; - и # 947; - вериги съдържат сложни олигозахариди са свързани с останките на Asn. Краищата на фибриноген молекули имат силно отрицателен заряд; това се дължи на присъствието на големи количества аспартат и глутамат остатъци в област на веригата А # 945; и в областта на верига в региона в # 946; (Фиг. 1). В допълнение, в региона на веригата на B # 946; Той съдържа необичайно отрицателно зареден остатък тирозин-О-сулфат. Отрицателно заредени края на фибриноген молекули не само насърчаване на последната разтворимостта във вода, те изтласкват краищата на други молекули на фибриногена, които предотвратява агрегацията на последната.
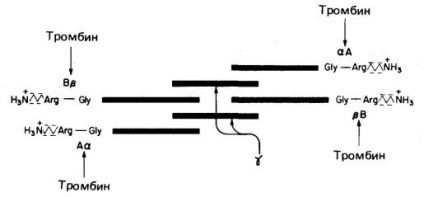
Фиг. 1. Схематично представяне на фибриноген, неговата структура (А # 945; в # 946; # 947) 2. зарежда всички, тромбин сайтове на разцепване (стрелки) четири пептидни връзки Arg - Gly.
Тромбинът - е серинова протеаза с пристан. м Асса 34000, състоящ се от две полипептидни вериги. Четири тромбин хидролизира пептидни връзки Arg - Gly в фибриноген (Фигура 1.). От тези четири облигации свържете два региона А и # 945;. , а другите две - в областта и # 946; верига A # 945; и B # 946; съответно. Премахната от молекулни фрагменти фибриноген А и В са отрицателно заредени фибринопептид. резултатът е фибринов мономер със структура ( # 945; # 946; # 947; ) 2. Дълги неразтворими фибрин мономери спонтанно свързват в редовна зигзаг структура; резултатът е полимер, неразтворим фибринов съсирек. Той улавя червени кръвни клетки, тромбоцити и други кръвни съставки, което води до червен тромб или бял тромб (щепсел на тромбоцитите). На ранен етап на фибриновия съсирек е неконсолидирана формация доста, задръжте само система nekovalentnosvyazannoy неразтворим фибрин мономери.
тромбин функция в допълнение към превръщането на фибриногена във фибрин е коефициентът за превод XIII в неговата активна форма (XIII а). Фактор X III а (трансглутаминаза) "бод" на фибринови мономери чрез образуване на изопептидна връзки между специфичен # 947; - карбоксамид група на глутамин и # 949; амино група на лизин (фиг. 2). Такова стабилизиране на фибриновия съсирек улеснява неговото оттегляне. което може да се наблюдава ин витро. Повишено кървене се наблюдава при пациенти с наследствена недостатъчност на фактор XIII. Това се дължи на невъзможността да се формира стабилно фибрин съсирек.
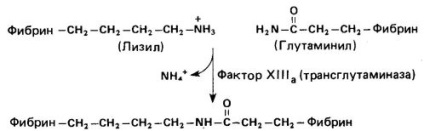
Фиг. 2. Кръстосано свързване на фибринови молекули чрез действието на активиран фактор XIII.
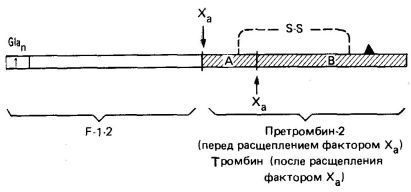
Фиг. 3. Схематично структурата на протромбин, N 'край - в ляво; Регион I включва всички следи от Gla. Показване на местата на разкъсване и фактор X, и наименованието на продуктите на разпада. Локализация на каталитично активна серин остатъкът означен със ▲. А- и активен тромбин В верига (защрихованата) се държат заедно с дисулфиден мост.
Активирането на протромбиновото настъпва на тромбоцитите; Този процес включва тромбоцитите анионен фосфолипид. Са2 + йони. фактори Va и Ха.
Фосфолипидите, които са от вътрешната страна на плазмената мембрана на тромбоцитите, изложени в резултат на колаген-индуцираната тромбоцитна дегранулация и унищожаване. Тези фосфолипиди свързват Са2 + йони и протромбин (последното от N-терминалния регион, съдържащ остатъците GLA). Тромбоцитите също да съдържат фактор В. който е в активирана форма (Va) се свързва със специфични рецептори върху мембраната на тромбоцитите (фиг. 4). Фактор Va е рецептор за фактор Ха, който от своя страна се свързва протромбина в F -1-2 (фиг. 3). Фактор Ха е серин протеаза, разцепва това каталитично неактивна протромбиновото молекула в областите, посочени на фиг. 3. Това освобождава N-крайната част на протромбин. В резултат на тромбин разцепване на фактор X и тромбин произведени полипептиди А и В, свързани с дисулфиден мост.
Свързването на фосфолипид чрез Са2 + йони с протромбиновото Gla остатъци усилва активирането на последните в 50-100 пъти. Това се случва, очевидно поради създаването и X (фиг. 4), с висока локална концентрация на протромбиновото и фактор. Фактор Va причинява повишено активиране на протромбиновото е около 350 пъти и чрез увеличаване на локалната концентрация на фактор Ха.
Фактор Va. образуван от действието на тромбина фактор В. впоследствие същото инактивиран тромбин и по този начин ограничава от активирането на протромбин до тромбин.
Протромбиновото може да се активира stafilokoagulazoy Получената конформационни промени.
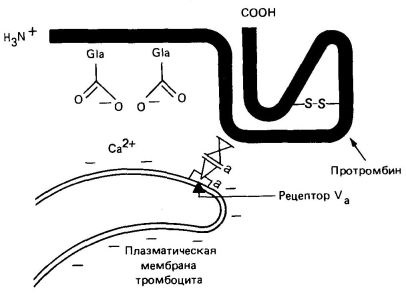
Фиг. 4. Диаграма Va свързване фактори. Ха. Са + 2 йони и протромбиново от плазмената мембрана на тромбоцитите.
Активирането на фактор X
Външният път на Фактор Ха
комуникация празнина Arg - Ил. и по този начин превръщането на фактор X до фактор Ха, се извършва съвместно и фактор VII и тъканен фактор на външния път. Фактор VII и работи само на външния път, който се активира бързо след травма на тъкан. Прекурсорът на фактор VIIa - фактор VII (един Gla -съдържащ гликопротеин) - се синтезира в черния дроб и може да се активира от тромбин или фактор Ха. Фактор VII - е зимоген, но има сравнително висока ендогенна активност. Тъканен фактор ускоряване фактори действие VII или Vila, на фактор X. съдържа в по-голямо количество в плацента, бял дроб и мозъка.
В 1 мл плазма съдържа приблизително 3 мг фибриноген и само 0.01 мг на фактор X. Това означава, че в коагулационната система трябва да става амплификация. Всъщност, превръщането на фактор X до X а - автокаталитично процес, който може да се счита като усилване. преглед на реакциите на панела не е лесно да се разбере какво е първичното - "кокошката или яйцето"; в този случай - и фактор II (тромбин) или фактор Ха (Фигура 5.).
Вътрешен път на фактор X и
Вътрешна път на фактор X и започва с взаимодействието ин виво прекаликреинов. кининоген високо молекулно тегло. фактори XII и XI върху повърхността на активиращ е вероятно да колаген (фиг. 6). Активиране на повърхността на вътрешния път в ин витро експерименти е стъкло и каолин. Взаимодействието на фактор XII с повърхността на активиращ което го прави по-достъпни за протеолитично атака каликреин. В резултат на каликреин образува II Фактор Ха, което от своя страна предизвиква преход прекаликреинов в каликреин. Следователно, съществува взаимна активиране. Фактор II и X освобождава брадикинин от високо кининоген молекулно тегло и активира фактор X до XI и I. I и Фактор X чрез две последователни реакции активира фактор IX (Gla -съдържащ зимоген). I фактор Ха в присъствието на Са2 + йони и кисели фосфолипиди бавно активира фактор X; активиране се осъществява чрез разцепване на същата връзка Arg - Il Е, който разцепва Фактор Vila на външния път. Скоростта на фактор X активиране на фактор Ха се увеличи 500 пъти в присъствието на фактор VIII (или Villa). За активиране на фактор VIII. очевидно имате нужда от малко количество тромбин. Фактор VIII не е протеаза; вероятно е рецептор за фактор IX и разцепването на Arg последното съобщение - Il д в фактор X. Вътрешният път на кръвосъсирването - бавен процес, тъй като голям брой фактори са включени в него. Заедно те образуват механизъм каскада, която генерира фактор Ха (виж фиг. 6).
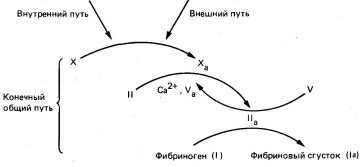
Фиг. 5. Връзката на вътрешна, външна и краен общ път в съсирването на кръвта.
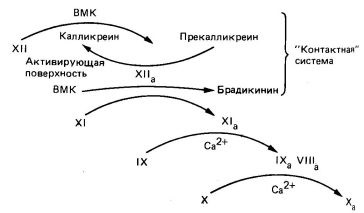
Фиг. 6. вътрешен път активиране на фактор X до X на. WMC - високо кининоген молекулно тегло.
Има редица на човешките наследствени заболявания, причинени от недостиг на различни компоненти на системата на кръвосъсирване. Най-често се наблюдава дефицит на фактор VIII. решаващия хемофилия А (съответната генна локализиран в хромозома 10 на човек). Това заболяване е играл важна роля в историята на кралските династии в Европа.
Нормално плазма се характеризира с няколко типа антитромбиновата активност. Малък принос го прави # 945; 1-антитрипсин. залог специфичен # 945; 2 глобулин представлява около 25% от плазма антитромбиновата активност. Той образува необратими комплекс с тромбин и други протеази, по този начин предотвратяване свързването на тези ензими в техните естествени субстрати. # 945 2-глобулин се счита 945 # 2 инхибитор на плазмин, тъй като тя също инактивира плазмин, който е серинова протеаза с фибринолитична активност.
Най-антитромбин дейност, присъща на антитромбин III. Антитромбин III има малко ендогенна активност и силно се активира в присъствието на хепарин, с висока отрицателен заряд. Хепарин изглежда да е свързано с конкретна катионен част на антитромбин III. предизвиква конформационна промяна в молекулата си. В резултат на тази промяна, антитромбин III придобива способността да комуникира с всички серинови протеази, включително трипсин, химотрипсин и плазмин. В системата на кръвосъсирването Антитромбин III инхибира активността на тромбин, фактор Ха I, Па, Ха и X I и II. Индивидите с наследствен дефицит на антитромбин наблюдава тенденция да се образуват кръвни съсиреци. Може да се заключи, че анти-тромбин изпълнява физиологични функции и че нормалния процес на кръвосъсирването при хора е много динамична система.
Хепарин често се използва в клиничната практика като лекарство, което предотвратява образуването на кръвни съсиреци. Основният фактор за определяне на антикоагулантната активност на хепарин е да ги активирате антитромбин III. което от своя страна инхибира серин протеази обсъдени по-горе. Известно е, че малко количество хепарин е на стените на кръвоносните съдове, като по този начин намаляване на активирането на вътрешния път. Антикоагулантната активност на хепарин може да бъде потиснато силно катионни полипептиди (например, протамин). Такива полипептиди конкурират с катионни места на антитромбин III за свързване на полианионно хепарин.
група кумаринови лекарства инхибират витамин К-зависимо карбоксилиране на Glu остатъка. води до образуването на N-терминалния остатък Gla фактори II. VII. IX и X. Всички тези фактори се синтезира в черния дроб, и образуването на Gla остатъци, необходими за зреене и следователно нормалната работа на вътрешни, външни и общо крайните пътища на коагулация. Очевидно, кумарин лекарства инхибират възстановяване хинон производни на витамин К хидрохинон в активна форма. Приложението на витамин К премахва блок, наречен кумарин и осигурява съзряване в -зависима коагулационни фактори на черния дроб Gla. Манипулиране действия кумарин витамин К се среща само 12-24 часа; лечение на антикоагулантна активност на хепарин с протамин се появява почти веднага; Тази разлика се дължи на естеството на антагонистични механизми.
Има сериозни доказателства, че системата за съсирване на кръвта обикновено е в динамично равновесие, непрекъснато формира, в която се съсирва на фибрин и след това се разтварят. Плазминът е серин протеаза, способна да хидролизира фибрин и фибриноген, V и VIII фактори. допълва фактори и различни полипептидни хормони. Обикновено намерени в плазмата плазмин в неактивна форма проензим (плазминоген). Има различни видове на плазминогенни активатори в повечето тъкани на тялото. Активатор на тъканния плазминоген - е серин каталитично неактивен при липса на контакт с фибрин. Да бъдеш в контакт с фибрин, молекула плазминогенен активатор е в състояние да се привърже плазминоген до образуването на плазмин. Когато плазмин хидролизира фибрин, активатор на плазминоген губи своята дейност и протеолитични избледнява. Това осигурява ефективно регулиране на процеса на фибринолиза. Много обещаващ е използването за терапевтични цели на тъканен плазминогенен активатор (ТАП), получен чрез генно инженерство. TPA насърчава възстановяването на коронарен проходимост, като по този начин намаляване на увреждане на миокарда, което се случва в остра коронарна тромбоза. Друг плазминогенен активатор - протеолитичен ензим урокиназа - се съдържа в урината. Урокиназа - е серин протеаза; тя може да активира плазминоген, да го разделите на две места.
Плазминоген обикновено се утаява с фибрин и следователно е част от фибриновия съсирек. Получената активирането на плазмин разцепва фибрин молекула в разтворими фрагменти, и съсирек изчезне (разтваряне). Фибриновите съсиреци омрежени трудно се разтварят чрез плазмин.
Концентрацията на плазминогенни активатори увеличава в редица заболявания, включително някои форми на рак и в шок. Antiplazminovaya дейност е довела # 945; 1-антитрипсин и 945 # 2 инхибитор на плазмин може да се намали в чернодробна цироза. Някои бактериални продукти, такива като стрептокиназа способен да активира плазминоген без разделяне на молекулите и могат да бъдат отговорни за дифузно кървене, понякога се наблюдава при пациенти с разпространени бактериални инфекции.
Свързани статии
