Сорбция (лат sorbeo -. Абсорбира) - абсорбцията на твърдо тяло или околните течна среда различни вещества. Абсорбираният вещество в околната среда, наречена сорбат (sorbtivom), абсорбиращ твърдо тяло или течност - сорбент.
Поради естеството на абсорбция на сорбат сорбционни явления са разделени на два типа: адсорбция - концентрация на разтвореното вещество в интерфейса или абсорбция повърхностен слой и абсорбцията на сорбент - обемен абсорбция при което разтвореното вещество се разпределя в целия обем на сорбента.
От друга страна, има два вида на адсорбция - physisorption при което повишена концентрация на разтвореното вещество в интерфейса поради неспецифичната (т.е., не зависи от естеството на веществото) от ван дер Ваалс сили и химически адсорбция (хемисорбция) поради химични реакции сорбат повърхност сорбентен материал. Физическата адсорбция slabospetsifichna обратим и термичен ефект е малък (няколко кДж / мол). Хемисорбция селективен, обикновено необратимо и топлина от десетки до стотици (кислород хемисорбция на метали) кДж / мол.
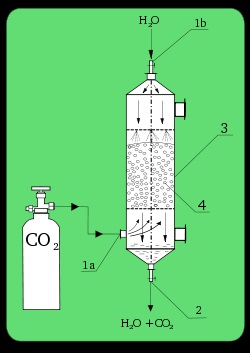
Лабораторни абсорбер. 1а). входящия СО2; 1б): вход Н2 О; 2). освободи; 3). колона абсорбция; 4). пълнител.
Абсорбция в химията - физическа или химическа явление или процес. където атома. молекули или йони влизат в kakoo обемно състояние - газ. течно или твърдо тяло. Този процес е различен от адсорбцията. тъй като молекулите подложени на абсорбция изкачване на обем, отколкото на повърхността (както е в случая на адсорбция). По-общо понятие - сорбция която обхваща абсорбционни процеси, адсорбция и йонообменна. Абсорбцията, общо взето - това е процесът, при който нещо добавя друго вещество. [1]
Ако усвояване е физически процес, който не се придружава от други физически или химически процес, обикновено е подчинен на закона на Нернст разпределение:
"В равновесие на съотношението на концентрациите на третия компонент в двете течни страни е постоянна.";
KN постоянен обем зависи от температурата и се нарича коефициента на разпределение. Това равенство е вярно, при условие че концентрацията не е твърде голям, и ако молекулите са "х" не се променя формата си по някакъв друг от двете страни. Ако тази молекула е изложен на сдружение или дисоциация. след това уравнение все още описва като баланс между "Х" и в двете държави, но само в една и съща форма - концентрацията на всички останали форми трябва да се изчисляват, като се вземат предвид всички друго равновесие. [1]
В случай на поглъщане на газ може да се изчисли с помощта на концентрацията на такъв идеален право на газ. с = р / RT. Алтернативно, може да се използва вместо парциалното налягане на концентрация.
Много технологично важни процеси, химическа абсорбция се използват вместо физичен процес като абсорбция на въглероден диоксид с натриев хидроксид - тези процеси не следват разпределението на Нернст право.
При някои примери на този ефект може да се счита за екстракция. в която компонент може да бъде отстранен от единичен разтвор в течна фаза и се прехвърля към друг без химична реакция. Примери за такива решения - благородни газове и осмиев оксид. [1]
