Задача 1.
Разтвор, съдържащ 34 г калиев хидроксид и натриев хидроксид, сместа се неутрализира с излишък от солна киселина. В резултат на 47,9 грама на образувани соли. Определя се теглото на всеки от хидроксиди в сместа.
дадено:
тегло смес от хидроксиди на оригиналния р-D: m (КОН + NaOH) = 34 грама;
соли маса след неутрализация разтвор: сол = 47,9 грама msmesi
Намерете:
калиев хидроксид в теглото на първоначалната смес: M (КОН) =?
тегло на натриев хидроксид в смес от изходния: M (NaOH) =?
решение:
Компонентът смес две (КОН и NaOH) едновременно взаимодейства със солна киселина. Добави за всяко вещество, смес тяхната химична реакция:
КОН = КС1 + НС1 + Н 2О
НС1 + NaOH = NaS1 + Н 2О
За да се реши този проблем е възможно, чрез прилагане на противоналягане алгоритъм. Той може да бъде представен, както следва:
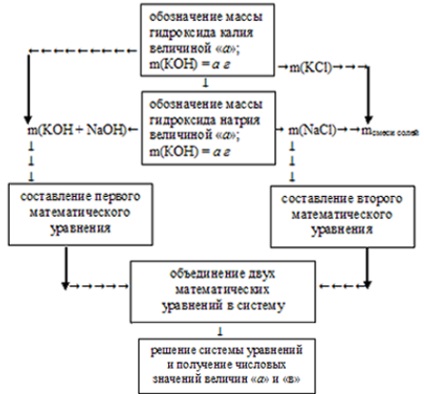
Предметът е необходима за определяне на масата на всеки от хидроксиди, следователно КОН означават стойност тегло "а" и тегло NaOH стойност "в".
1. С помощта на тези ценности, част от първото математическо уравнение. За да се равнява на сумата от общата маса хидроксиди теглото си в изходния разтвор:
А + В = М (КОН + NaOH) = 34 грама,
А + В = 34.
Вземете едно математическо уравнение с две неизвестни.
2. Сега, използвайки стойността от "а" и "в", както е известно от уравненията определят реакцията на неутрализация маса получена сол:
Дали размер на:
и г КОН дават х г калиев хлорид (от предположение)
56 грама на КОН се получи 74,5 грама на КС1 (от уравнение)
Дали размер на:
г NaOH в даден х г NaS1 (с предположение)
40 грама NaOH получаване на 58,5 грама NaS1 (от уравнението)
3. От известните условия, че общата маса на соли, получени е 47,9 грама Използване на стойностите, получени в предишния етап, представлява втора математическо уравнение с две неизвестни:
4. Комбинирайте двете математическите уравнения в системата:
Решението на тази система от уравнения дава стойностите са:
а = 13,4 грама; В = 20,6 грама
Стойността на "а" ние означаваме масата на КОН, следователно:
стойността на "С" ние означаваме масата на NaOH, следователно:
Отговор: m (КОН) = 13,4 грама; m (NaOH) = 20,6 грама
Проблем 2.
92 грама от калциев карбонат и смес от безводен калциев нитрат калциниран, докато отделянето на газ. В резултат на това се откроява смес от газове, имащи относителна плътност на водород е 21.63. Определя се теглото на всяка сол в изходната смес.
дадено:
тегло смес от соли: miskhod. cmesi [СаСОз 3) + Са (NO3) 2] = 92 д;
относителната плътност на сместа от водороден газ: D (Н2) = 21.63.
Намерете:
тегло на калциев карбонат като изходен смес: M (СаСО3) =?
тегло калциев нитрат в изходната смес: m [Са (NO3) 2] =?
решение:
Пишем реакцията на разлагане на всяка от солите:
За решаване на необходимостта да се използва брояч алгоритъм:
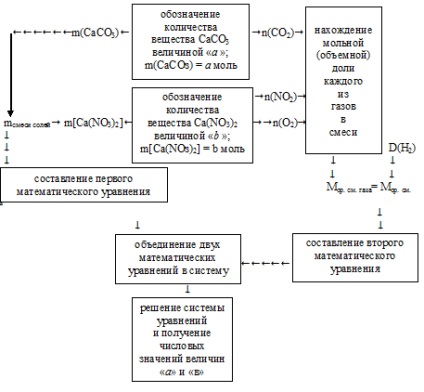
Тя се прилага алгоритъмът представени.
1. неизвестни количества са солите на масата на храната. За удобство на допълнителни изчисления приемлива стойност "а" означават количеството вещество (п мола) калциев карбонат: N (СаСО3) и = мол.
Стойност «б» означават количеството вещество (п мола) калциев нитрат: N [Са (NO3) 2] = б мол.
Следователно, по отношение на моларните маси на тези соли може да премине към самите маси соли:
2. Общо количество на изходните соли съдържа състоянието. Това ви позволява да направите първата математическото уравнение с две неизвестни:
3. Освен това, с помощта на входните стойности "а" и "в", от реакциите на разпадане уравненията определи количеството вещество на всеки от газовете:
п = а п = х мол мол
СаСО3 = СаО + CO2 ↑
п = п = 1 мол 1 мол
Да се изготви част:
и х мол СаСО3 получаване мол CO2 (съгласно условия)
1 мол на СаСО3 дава 1 мол CO2 (от уравнение)
Да се изготви част:
б мола Са (NO3) 2 х мола NO2 получаване на (в зависимост от условията)
2 мола Са (NO3) 2 се получава 4 мола NO2 (от уравнение)
б мола Са (NO3) 2 добив в мол 2 (съгласно условия)
2 мола Са (NO3) 2 дават 1 мол 2 (от уравнение)
4. Определяне на молната фракция на всяка газ в сместа (като част от единство).
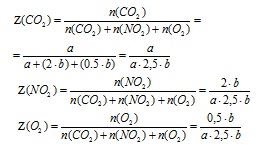
5. Определяне на средна молна маса от стойностите на газовата смес на тяхната част от мол в сместа.
По закон Авагадро мол на газ в сместа е числено равно на обемната фракция (газ само), така че формулата за определяне Mcredn. вместо обемна фракция на (Z) заместител
стойност на молната фракция () на съответния газ.
6. Определяне на средна моларна маса на сместа газ съгласно относителната плътност.
7. Приравняването експресията MSR. газова смес, получена в последните две стъпки, представляваща втори математическо уравнение:
8. Комбинирайте уравненията, получени във втората и седмата операции в
В са получени неговите стойности решения: а = 0,1; б = 0,5.
Количествата "а" и "б", ние определени количество вещество СаСО3 и Са (NO3) 2 в изходната смес от соли по този начин:
9. Определяне на теглото на солите в изходния смес:
- Вие сте тук:
- основен
- задачи
- ЕГЕ-химия
- Селективно разделяне на смеси | Цел 1
Свързани статии
