Тъй като степента на електролитната дисоциация електролитна дисоциация - обратим процес, заедно с техните йони и молекули, присъстващи в електролитни разтвори. С други думи, различни електролити, съгласно теорията на Арениус С разпадат в йони в различна степен. Тегло гниене (електролит сила) се характеризира с количествена стойност - степента на дисоциация. Степента на дисоциация (# 945; на гръцката буква а) - е съотношението на молекули на разпада на йони (п), общият брой на разтворените молекули (N):
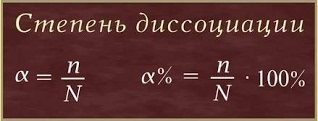
Стойността на степента на дисоциация (# 945)
1. разтворими соли; 2. Силни киселини (HCl, HBr, HI, HNO3 NClO4 H 2SO 4 (разредена) ...); 3. Силни основи - алкални.
1. Почти всички органичната киселина (CH3 СООН, С2 Н5 СООН, и т.н.); 2. Някои неорганична киселина (Н2 CO3 Н2 S, и др ...); 3. Почти всички солта на ниска разтворимост във вода, основа и амониев хидроксид (Са 3 (РО 4) 2; Си (ОН) 2; Al (ОН) 3; NH4 OH); 4. водите.
1) След като химически форума един студент пише: "Най-накрая мога да разбера (което е написано) защо разтвор на натриев хлорид се разлага на Na + и Cl -. а не на Na - и Cl + ». Как бихте обяснили бедният човек това, което се случва в решението? Какво важна част от химията по това време, "разходка", нашият нещастен ученик?
Примери за решаване на проблеми:
Задача 1. Определяне какво е степента на дисоциация на електролита, ако при 20 ° С на всеки 150 молекули разделят на йони 90. силен или слаб електролит е?
Задача 2. определи колко молекули дисоциират в разтвора на електролит, ако степента на дисоциация на електролита е 0.1, и разтворът се въвежда 3.01 • 20 октомври молекули.
Задачи за самоконтрол
1. Изчислява степента на дисоциация на борна киселина Н 3ВО 3. ако е известно, че в разтвора на всеки 500 молекули разделя на йони само 40. силна, средна или слаба сила на електролита?
2. изчисли колко молекули prodissotsiiruet електролитен разтвор от всеки 120 молекули ако дисоциация степен е 95%.
Свързани статии
